Eisen-Schwefel-Cluster
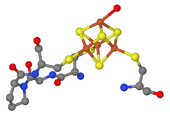

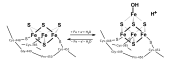

Eisen-Schwefel-Cluster (Fe-S-Zentren) sind Mehrfachkomplexe aus Eisen und Schwefel der Größe von Clustern, die als Kofaktoren an Enzymreaktionen beteiligt sind. Am häufigsten und stabilsten sind (4Fe-4S) und (2Fe-2S). Im Allgemeinen werden Cluster zerstört, wenn sie für freien Sauerstoff zugänglich sind. Die Zugänglichkeit ist vom Schutz des bindenden Enzyms abhängig.
Diese Fe-S-Zentren wirken in Enzymen als Elektronentransferreaktanden, Lewis-Säuren und Radikal-Generatoren. So kann beispielsweise Stickstoff in Ammoniak, Wasserstoff in Protonen und Kohlenmonoxid in Kohlenstoffdioxid umgewandelt werden:
Die Eisenatome der Zentren werden durch anorganisches Sulfid und die Seitenketten von Aminosäuren koordiniert. Cysteine können beispielsweise über ihre Thiolgruppe koordinieren (s. Abb.).
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Bereits unter reduzierenden, wässrigen Bedingungen bilden sich spontan rhombische (2Fe-2S)-Komplexe. Weitere Metallionen, z. B. Nickel oder Molybdän können in den Komplex in Folge aufgenommen werden. Dies geschieht im Organismus besonders effektiv unter Beteiligung eines Proteinkomplexes, der das Eisen-Schwefel-Cluster-Gerüstprotein (ISCU) enthält.
Dabei übernimmt ISCU die Rolle der Bindung der Eisenatome, die von ISCA herantransportiert werden, während das Enzym Cystein-Desulfurase unter Cysteinverbrauch Schwefelatome bereitstellt. Zunächst wird (2Fe-2S) zusammengestellt, das durch Dimerisierung schließlich (4Fe-4S) wird. Dieser Prozess kann sowohl in den Mitochondrien als auch im Zytosol stattfinden, wonach der fertige (4Fe-4S)-Komplex ins Plasma transportiert oder gleich in bereitstehende Enzyme eingebaut wird.[1][2][3][4]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Anaerob lebende Bakterien und Archaeen enthalten teilweise auch sauerstoffempfindliche Enzyme mit einem nickel-, eisen- und schwefelhaltigen Zentrum, das als Cluster C bezeichnet wird.
Das Enzym Nitrogenase enthält als Kofaktor einen Fe-Mo-S-Cluster.
Eisen-Schwefel-Cluster kommen in Mitochondrien, Mitosomen und Hydrogenosomen vor.
Liste der menschlichen Proteine mit (2Fe-2S)[Bearbeiten | Quelltext bearbeiten]
- NADH-Dehydrogenase, Succinat-Dehydrogenase und Cytochrom-c-Reduktase (Komplex I, II und III der Atmungskette, Citratzyklus)
- Adrenodoxin (Synthese der Thyroidhormone)
- Xanthinoxidase (Nukleotidmetabolismus)
- Aldehydoxidase (Biotransformation, Abbau von Nikotin)
- Ferrochelatase (Porphyrinmetabolismus)
- Miner1 und Miner2
Liste der menschlichen Proteine mit (4Fe-4S)[Bearbeiten | Quelltext bearbeiten]
- NADH-Dehydrogenase und Succinat-Dehydrogenase (Komplex I und II der Atmungskette, Citratzyklus)
- Aconitase (Citratzyklus)
- Amidophosphoribosyltransferase (Purinstoffwechsel, Inosinmonophosphat-de novo-Synthese)
- Dihydropyrimidin-Dehydrogenase (Aminosäuresynthese, Synthese von β-Alanin)
- IREBP2 (Eisenstoffwechsel)
- Lipoylsynthase (Proteinmodifizierung)
- die Kernenzyme DNA-Primase und Endonuklease III-like
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Literatur[Bearbeiten | Quelltext bearbeiten]
- H. Dobbek: Wie biologische Fe-S-Zentren CO2 aktivieren. In: Nachrichten aus der Chemie. Band 56, Nr. 7–8, 2008, S. 734–737, doi:10.1002/nadc.200857949.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Beinert H: Iron-sulfur proteins: ancient structures, still full of surprises. In: J. Biol. Inorg. Chem. 5. Jahrgang, Nr. 1, Februar 2000, S. 2–15, doi:10.1007/s007750050002, PMID 10766431.
- ↑ Rouault TA, Tong WH: Iron-sulfur cluster biogenesis and human disease. In: Trends Genet. 24. Jahrgang, Nr. 8, August 2008, S. 398–407, doi:10.1016/j.tig.2008.05.008, PMID 18606475, PMC 2574672 (freier Volltext).
- ↑ Chandramouli K, Unciuleac MC, Naik S, Dean DR, Huynh BH, Johnson MK: Formation and properties of [4Fe-4S] clusters on the IscU scaffold protein. In: Biochemistry. 46. Jahrgang, Nr. 23, Juni 2007, S. 6804–11, doi:10.1021/bi6026659, PMID 17506525.
- ↑ Yang J, Bitoun JP, Ding H: Interplay of IscA and IscU in biogenesis of iron-sulfur clusters. In: J. Biol. Chem. 281. Jahrgang, Nr. 38, September 2006, S. 27956–63, doi:10.1074/jbc.M601356200, PMID 16877383.


