Hüftgelenksarthrose
| Klassifikation nach ICD-10 | |
|---|---|
| M16 | Koxarthrose (Arthrose des Hüftgelenkes) |
| M16.0 | primäre Koxarthrose, beidseitig |
| M16.1 | primäre Koxarthrose, sonstige (einseitig, o.n.A.) |
| M16.2 | Koxarthrose als Folge einer Dysplasie, beidseitig |
| M16.3 | Sonstige dysplastische Koxarthrose (einseitig, o.n.A.) |
| M16.4 | Posttraumatische Koxarthrose beidseitig |
| M16.5 | Sonstige posttraumatische Koxarthrose (einseitig, o.n.A.) |
| M16.6 | Sonstige sekundäre Koxarthrose beidseitig |
| M16.7 | Sonstige sekundäre Koxarthrose (einseitig, o.n.A.) |
| M16.9 | Koxarthrose, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Die Hüftgelenksarthrose (lateinisch Arthrosis deformans coxae; von altgriechisch ἄρθρον arthron, deutsch ‚Gelenk‘, lateinisch deformare ‚verstümmeln‘ und lateinisch coxa ‚Hüfte‘), auch Coxarthrose (deutsch Koxarthrose), ist eine degenerative Erkrankung des Hüftgelenks, insbesondere im höheren Alter, der ein Verschleiß der Knorpeloberfläche von Hüftpfanne (Acetabulum) und Hüftkopf (Caput femoris) zu Grunde liegt. Sie ist die häufigste Form der Arthrose beim Menschen.
Ursachen für die Hüftgelenksarthrose können verschiedene (Vor-)Erkrankungen oder (Vor-)Verletzungen im Hüftgelenksbereich sein. Charakterisierend für die Krankheit ist ein belastungsabhängiger Schmerz direkt im Hüftgelenk. Dieser projiziert sich auf die Leiste, bei schmerzhafter Mitbeteiligung von Strukturen am großen Rollhügel auch auf die Oberschenkelaußenseite. Oftmals bestehen jedoch auch Schmerzquellen im Bereich der Lendenwirbelsäule und am Kreuzdarmbeingelenk.
Die Diagnose der Hüftgelenksarthrose erfolgt anhand von Röntgenbildern, die in der Regel sehr aussagekräftig sind und eine genaue Stadieneinteilung der Krankheit erlauben.
In der operativen Therapie dominiert der endoprothetische Hüftgelenksersatz, jährlich werden in Deutschland über 200.000 Erstimplantationen eines künstlichen Hüftgelenks vorgenommen.[1] Eine begleitende konservative Schmerzbehandlung kann sowohl vor als auch nach der Operation hilfreich sein. Die Prognose nach erfolgtem operativen Eingriff (Hüft-TEP) ist meist günstig.
Für das Gesundheitssystem entstehen durch die Hüftgelenksarthrose erhebliche Kosten. Die Vergütung der Therapie erfolgt gemäß der geltenden Fallpauschalen und Sonderentgelte, welche die Gesamtkosten aber nicht gänzlich decken. International ist ein deutlicher Kostenunterschied zu beobachten, insbesondere der Implantate.
Epidemiologie[Bearbeiten | Quelltext bearbeiten]
Die Prävalenz für eine klinisch-symptomatische Coxarthrose beträgt bei Männern 5 Prozent und bei Frauen 5–6 Prozent[2] und ist insgesamt aufgrund der alternden Gesellschaft ansteigend.[3] Damit ist sie, noch vor der Kniegelenksarthrose, die häufigste Form der Arthrose beim Menschen. Jährlich werden in Deutschland mehr als 200.000 Hüftprothesen wegen einer Coxarthrose implantiert[1] und davon mehr als 150.000 Eingriffe im Endoprothesenregister Deutschland erfasst[4].
Pathogenese (Ursachen)[Bearbeiten | Quelltext bearbeiten]
Arthrosen sind an den unteren Extremitäten häufiger vorzufinden als an den oberen, da diese beim Gehen und Stehen das ganze Körpergewicht tragen. Die Statik und Kinetik des aufrechten Ganges stellen dabei deutlich andere Anforderungen an das Gelenk als die Fortbewegung auf vier Beinen. Im Vordergrund der pathophysiologischen Prozesse, die zum Krankheitsbild der Coxarthrose führen, steht zunächst der Knorpelschaden am Hüftgelenk. Die anschließende großflächige Knorpelzerstörung, vor allem im Bereich der größten Druckbelastung, führt schließlich zur völligen Freilegung der Knochenfläche am Gelenk. Vereinfacht kann zusammengefasst werden:

- Abhängig von der Nutzungsdauer (d. h. Lebensalter) kommt es früher oder später zu Verschleißvorgängen. Die Knorpelschicht des Gelenks wird abgerieben und dadurch dünner.
- Der unter dem Knorpel gelegene Knochen wird vermehrter mechanischer Beanspruchung ausgesetzt und reagiert mit einer Verdichtung seiner Binnenstruktur (subchondrale Sklerosierung).
- Im weiteren Verlauf wird das Gelenk verformt (deformierende Arthrose), und der unter dem Knorpel gelegene Knochen wird löcherig (Geröllzysten).
- Um die Druckauffangzone zu verbreitern, baut der Körper Knochenmaterial an, mit dem die Hüftpfanne verbreitert wird (Osteophyten). Der Hüftkopf weist dann keine Kugelform mehr auf (präarthrotische Deformität), es kommt zu Gelenkschmerzen, Gelenksteifigkeit sowie zu einer Einschränkung des Bewegungsumfangs.
Diese vereinfachte Vorstellung, die von einer reinen Verschleißerscheinung ausgeht (sog. „wear and tear concept“), wird in der neueren Forschung differenzierter betrachtet: Die Coxarthrose wird – wie alle Arthrosen – als ein Krankheitsprozess von (bio-)mechanischen und zellulären Faktoren verstanden, dem ein Ungleichgewicht zwischen gelenkschädigenden und heilenden (reparativen) Mechanismen zu Grunde liegt. Überwiegen Fehlbelastung, destruktive Mechanismen oder überschießende Reparationsvorgänge, entwickelt sich das Bild der Arthrose – in diesem Fall der Coxarthrose.[5][6]
Die Ursachen der Coxarthrose sind vielfältig und werden grundsätzlich in zwei Gruppen eingeteilt: die primäre Coxarthrose und die sekundären Coxarthrosen:
Primäre Ursachen[Bearbeiten | Quelltext bearbeiten]
Bei den meisten Patienten im Alter von über 50 Jahren kann keine genaue Ursache für den Gelenkverschleiß festgestellt werden. Den Beschwerden liegt eine anlagebedingte Minderwertigkeit des Gelenkknorpels ohne jegliche Vorerkrankung zu Grunde,[7] die sich im höheren Alter aufgrund des oben beschriebenen natürlichen Abriebs bemerkbar macht. Diese Erscheinung wird idiopathische oder primäre Coxarthrose genannt.[8]
Sekundäre Ursachen[Bearbeiten | Quelltext bearbeiten]

Gelenkschäden und -deformitäten, meist im Kindesalter, sind eine weitere Ursache für die Coxarthrose. Diese führen aufgrund der nicht normal ausgebildeten oder zerstörten Gelenkflächen zu einer Verkleinerung der Kontaktflächen des Gelenks und damit zu einem erhöhten Belastungsdruck.[8] Dies führt dazu, dass das Gelenk „wie ein defekter Motor unrund“ läuft und so die Verschleißbildung beschleunigt.[7] Dadurch bildet sich bei den betroffenen Patienten die Arthrose auch wesentlich früher aus als bei der primären Form. Zu diesen sekundären Ursachen der Coxarthrose gehören:
- beschleunigte Abnutzungserscheinungen (beispielsweise durch Übergewicht)
- anlagebedingte Fehlformen wie Hüftdysplasien („Dysplasiecoxarthrose“), Coxa vara bzw. valga oder Durchblutungsstörungen des Hüftkopfes
- kindliche Hüfterkrankungen, zum Beispiel Morbus Perthes (→ Femurkopfnekrose) oder Epiphyseolysis capitis femoris (jugendliche Hüftkopflösung)
- Trauma (posttraumatische Coxarthrose, meist Folge einer Azetabulumfraktur bei schweren Verkehrsunfällen, insbesondere bei Stufenbildung in der Gelenkfläche)[9]
Seltene Ursachen sind außerdem:[10]
- auf dem Blutweg übertragene Infektionen des Knochens (Hämatogene Osteomyelitis)
- entzündliche Gelenkerkrankungen oder rheumatische Erkrankungen im weiteren Sinne.
Risikofaktoren[Bearbeiten | Quelltext bearbeiten]
Ein systematischer Literaturreview und eine Metaanalyse mit zehn relevanten Studien zur Dosis-Wirkungs-Beziehung zwischen schweren körperlichen Arbeitsbelastungen und Coxarthrose zeigen den Zusammenhang zwischen schweren körperlichen Arbeitsbelastungen und Coxarthrose. Alle Studien bestätigen konsistente Dosis-Wirkungs-Beziehungen bei Männern, allerdings nicht bei Frauen. Die Risikoverdopplungsdosen variieren abhängig von der berücksichtigten kleinsten Last bei der Dosisberechnung.[11][12]
Die Ergebnisse der Ulmer Osteoarthrose-Studie weisen auf einen Zusammenhang zwischen zunehmendem Alter, Diabetes mellitus, einer Gelenkvorerkrankung oder -verletzung auf der Gegenseite (kontralateral) und dem Auftreten einer beidseitigen (bilateralen) Coxarthrose hin. Bei einer einseitigen (unilateralen) Coxarthrose wurde ein starker Zusammenhang mit Gelenkvorerkrankungen und -verletzungen festgestellt. Risikofaktoren für den Befall mehrerer Gelenke (polyartikulär) sind Gelenkvorerkrankungen bzw. -verletzungen, höheres Alter, weibliches Geschlecht, familiäre Vorbelastung sowie Gicht. Gelenkspezifische Risikofaktoren sind angeborene oder durch Verletzungen verursachte Veränderungen.[13]
Symptome[Bearbeiten | Quelltext bearbeiten]
Typisches Symptom der Coxarthrose bei älteren Menschen ist ein belastungsabhängiger Schmerz, der hauptsächlich von der Begleitsynovitis verursacht wird, aber nicht obligat ist.[7] Differenzialdiagnostisch kann das Schmerzgeschehen aber bei der Unterscheidung der Coxarthrose von den entzündlichen Gelenkerkrankungen dienen, die typischerweise belastungsunabhängige Schmerzen verursachen.[14]
Die Beschwerden werden direkt im Hüftgelenk empfunden. Typischerweise sind die meisten Patienten nach einem morgendlichen Einlaufschmerz zunächst beschwerdefrei, bis die Beschwerden, entsprechend der täglichen Gelenkbelastung, zum Abend hin wieder stark zunehmen. Die Schmerzcharakteristik wird von betroffenen Patienten als „bohrend“ oder „dumpf“ beschrieben. Im Laufe der Jahre nehmen die Beschwerden kontinuierlich zu. Zwischendurch können auch Phasen vorübergehender, schubartiger Verschlimmerungen vorkommen, die als aktive oder dekompensierte Arthrose bezeichnet werden. Mit zunehmender Arthrose nimmt die Einschränkung der Beweglichkeit im Hüftgelenk ab.
Diagnostik[Bearbeiten | Quelltext bearbeiten]
Die Diagnose einer Coxarthrose wird, nach klinischer Untersuchung durch den behandelnden Arzt sowie nach dem Befund der Röntgenuntersuchung gestellt. Generell wird zwischen radiologischer und klinischer Einteilung unterschieden. Die geläufigen Einteilugsschemata dienen häufig weniger der Therapieentscheidung, sondern in erster Linie der Beurteilung von Behandlungsergebnissen (Qualitätsmanagement) und werden auch bei Verlaufskontrollen im Rahmen klinischer Studien eingesetzt.
Klinische Untersuchung[Bearbeiten | Quelltext bearbeiten]
Die Inspektion ist in der Regel wenig auffällig. Besonders beim liegenden Patienten können jedoch bei fortgeschrittenen Arthroseformen Unterschiede in der Beinlänge bestehen. Häufig fällt im Gangbild ein Entlastungshinken und eine Außenrotation des Fußes auf der betroffenen Seite (ca. 10–20°) auf. Die Standphase kann dadurch verkürzt sein.
Bei der Palpation steht typischerweise ein direkt am Leistenband (Ligamentum inguinale) lokalisierter Druckschmerz im Vordergrund, seltener auch über dem großen Rollhügel (Trochanter major) an der Außenseite der Hüfte. Die Druckschmerzhaftigkeit an der Außenseite wird durch die Überlastung der Gesäßmuskulatur (Glutaeus medius und Glutaeus minimus) verursacht, da durch den Knorpelabrieb die Gelenkmechanik verändert ist.
Klinische Stadieneinteilung[Bearbeiten | Quelltext bearbeiten]
Für die klinische Stadieneinteilung der Coxarthrose existieren u. a. folgende Scores:
- Score nach Merle d’Aubignè (1954)[15]
- Harris Hip Score (1969)
- Score nach Lequesne et al. (1987; umfasst den klinischen Schweregrad der Coxarthrose, die Aktivitäten des täglichen Lebens, die maximale Gehstrecke sowie den Schmerz in Dauer und Qualität)
- SF-36-Fragebogen (dient neben der Erhebung klinisch-anamnestischer und sozialmedizinischer Parameter auch der Analyse der Lebensqualität der betroffenen Patienten)
- Western Ontario Mac Master Arthritis Center (WOMAC) Arthrose-Index nach Bellamy und Buchanan (1986).
Radiologische Diagnostik[Bearbeiten | Quelltext bearbeiten]

unten: gesundes Hüftgelenk
Für die Diagnostik einer Hüftgelenksarthrose ist normalerweise eine röntgenologische Untersuchung ausreichend. Gewöhnlich werden Röntgenaufnahmen in zwei Ebenen durchgeführt:
- die Aufnahme im a.p.-Strahlengang (im Liegen oder im Stehen) sowie
- die Lauenstein-Aufnahme (im Liegen), die vor allem der seitlichen Darstellung des proximalen Oberschenkelknochens dient.
Zur Planung einer Hüftendoprothese wird die ap-Aufnahme als Beckenübersichtsaufnahme durchgeführt. Dies bedeutet, dass beide Hüftgelenke dargestellt werden. Diese Aufnahme kann im Stehen oder im Liegen durchgeführt werden.
Durch die oben aufgeführten Aufnahmemethoden sind in der Regel alle radiologischen Zeichen der Coxarthrose darstellbar.[7][16] Diese sind:
- Gelenkspaltverschmälerung: anfänglich im Hauptbelastungsbereich, breitet sich in der Folge über den gesamten Gelenkspalt aus
- Geröllzysten: werden besonders kranial der Hüftpfanne groß und verursachen die Inkongruenz der Gelenkfläche
- subchondrale Sklerosierung: besonders die Hüftpfanne ist betroffen
- Osteophyten: besonders lateral-kranial und medial-kaudal an der Hüftpfanne (Azetabulum); seltener am Oberschenkelknochenkopf („capital drop“)
Die radiologischen Zeichen der Coxarthrose sind zwar zuverlässig (Sensitivität 89 %, die Spezifität 91 %),[17] müssen allerdings nicht mit dem Ausmaß der Hüftbeschwerden und mit dem klinischen Befund korrelieren.
Das Röntgenbild kann auch Auskunft über präarthrotische Deformitäten, beispielsweise bei einer Hüftdysplasie (vgl. Abb.) als Ursache der Coxarthrose geben.[18] Hier ist der Hüftkopf nicht ausreichend überdacht und steht deswegen dezentriert nach oben/ seitlich heraus. Dadurch resultiert eine Verkürzung der Beinlänge. Im Laufe der Zeit kommt es zu einer massiven „Entrundung“ des Hüftkopfes, der Gelenkspalt ist fast ganz aufgehoben, das Hüftgelenk wird steif.
Weiterführende bildgebende Verfahren wie etwa Magnetresonanztomographie, Computertomographie, Szintigraphie oder Sonographie können in einzelnen Fällen erforderlich sein, beispielsweise bei der Frage nach Infekt oder zur computergestützten Planung einer Hüftendoprothese.
Radiologische Stadieneinteilung[Bearbeiten | Quelltext bearbeiten]

(1) (Rand-)Osteophyt
(2) subchondrale Sklerosierung
(3) Geröllzyste
(4) Gelenkspaltverschmälerung
Für die radiologische Stadieneinteilung wird die Klassifikation nach Kellgren und Lawrence („K & L“-Score; 1963) empfohlen, die die Arthrose in vier Stadien einteilt:[19]
| Grad | Beurteilung | Befund |
|---|---|---|
| 0 | normal | keine radiologischen Zeichen der Coxarthrose |
| 1 | Verdacht auf Coxarthrose | kleine Osteophyten, unklare Relevanz |
| 2 | geringfügige Coxarthrose | Osteophyten, Gelenkspalt normal |
| 3 | mäßige Coxarthrose | leichte Gelenkspaltverschmälerung, Geröllzysten |
| 4 | schwere Coxarthrose | ausgeprägte Gelenkspaltverschmälerung, subchondrale Sklerosierung, knöcherne Deformierungen des Hüftgelenkes |
Bei Befunden höher als Grad 2 wird meist die Diagnose einer Coxarthrose gestellt.[19] Weil der Nachweis von Osteophyten nicht zwangsweise mit dem klinischen Erscheinungsbild der Coxarthrose korreliert, ist die Klassifikation nach Kellgren und Lawrence nicht unumstritten.[20]
Differenzialdiagnosen[Bearbeiten | Quelltext bearbeiten]
Die oben genannten Beschwerden können allerdings auch durch andere Prozesse und Erkrankungen verursacht werden, die bei zweifelhaftem Befund differentialdiagnostisch ausgeschlossen werden müssen. Zu diesen gehören:[21][22]
- Erkrankungen der Lendenwirbelsäule: Durch Nervenwurzelreizung oder pseudoradikuläre Symptomatik können Schmerzen verursacht werden, die in die Hüfte ausstrahlen. Wegweisend für die Coxarthrose ist hierbei klinisch der Druckschmerz in der Leiste (im Gegensatz zu einem Druck- oder Klopfschmerz an der Lendenwirbelsäule) sowie Nervendehnungszeichen (umgekehrter Lasegue). Zur weiteren Differentialdiagnostik besteht die Option auf eine MRT-Untersuchung der Lendenwirbelsäule.
- Hüftkopfnekrose: Sie tritt besonders bei Männern zwischen dem 40. und 60. Lebensjahr auf; die genaue Klassifikation erfolgt mittels Röntgenbild und MRT. Auch bei sehr alten Patienten kann es durch die vollständige Destruktion des Hüftkopfes (Stadium IV) zum radiologischen Bild einer Hüftkopfnekrose kommen.
- Entzündliche systemische Erkrankungen: Besonders die Rheumatoide Arthritis und der Morbus Bechterew befallen das Hüftgelenk. Im Gegensatz zur Coxarthrose beklagen die Patienten aber eine ausgeprägte Morgensteifigkeit. Für die weitere Diagnostik spielen hier Entzündungswerte im Blut sowie die Rheumaserologie eine wichtige Rolle.
- Beschwerden in der Leistenregion: Sie können durch Leisten- und Schenkelhernien verursacht werden, sind aber schon in der klinischen Untersuchung leicht von der Coxarthrose zu unterscheiden.
Therapie[Bearbeiten | Quelltext bearbeiten]
Konservative Therapie[Bearbeiten | Quelltext bearbeiten]
Eine kausale konservative Therapie der Coxarthrose ist bisher nicht möglich. Ziel der konservativen Therapie ist daher die Schmerzlinderung sowie die mechanische Entlastung des betroffenen Hüftgelenks:[23]
Zur Entlastung des Gelenks können durch Hilfsmittel, wie Gehstock, Unterarmgehstützen oder Rollator, eingesetzt werden. Zudem können weiche Schuhabsätze („Pufferabsatz“) die Belastung erheblich senken. Bei Adipositas sollte eine Gewichtsabnahme angestrebt werden. Ferner kann eine Anpassung des Wohnraums erforderlich sein.
Gleichzeitig können durch physiotherapeutische Maßnahmen die Mobilität des Patienten gefördert, Muskeln gestärkt und Kontrakturen verhindert werden. Hydrotherapie (z. B. Bäder), Wärmetherapie (z. B. Moorbad) und Phototherapie können zusätzlich durch muskelrelaxierende und analgetische Effekte Linderung verschaffen.
Die medikamentöse Schmerzlinderung erfolgt hauptsächlich durch den Einsatz oraler nichtsteroidaler Antiphlogistika (aus der Gruppe der COX-2-Inhibitoren). Diese sollten jedoch aufgrund der gastrointestinalen Nebenwirkungen (insbesondere der gleichzeitigen Einnahme von Blutverdünnern) sowie bei vorbestehender Nierenschwäche nicht über einen längeren Zeitraum regelmäßig eingenommen werden. In ausgewählten Fällen kann auch eine Injektion mit Kortison ins Gelenk oder an den Trochanter major in Betracht gezogen werden[24], wobei dies das Risiko für einen Infekt hat bzw. für einen späteren periprothetischen Infekt erhöht.
Operative Therapie[Bearbeiten | Quelltext bearbeiten]
Überblick[Bearbeiten | Quelltext bearbeiten]
Die operative Therapie ist bei einer röntgenologisch nachgewiesenen Coxarthrose mit erheblichen funktionellen Beeinträchtigungen im Alltag und Beruf indiziert, insbesondere wenn die konservative Therapie nicht mehr ausreicht. Mittlerweile ist der endoprothetische Ersatz das Mittel der Wahl mit sehr guten Langzeitergebnissen[25]. In seltenen Fällen kann, vor allem bei Gelenkflächeninkongruenz, auch eine gelenkerhaltende, hüftgelenksnahe Korrekturosteotomie in Betracht gezogen werden.[26]
Hüftgelenksnahe Osteotomie[Bearbeiten | Quelltext bearbeiten]

Die hüftgelenksnahe Osteotomie wird seit über 200 Jahren bei der Behandlung der Coxarthrose eingesetzt, ist jedoch als operatives Verfahren weitgehend von der Endoprothetik verdrängt worden. Heutzutage wird sie vor allem bei der Therapie kindlicher Hüftgelenkserkrankungen verwendet. Die Operation findet meist schon im Kindesalter oder in der frühen Jugend statt, um der Entwicklung einer Coxarthrose zuvorzukommen. Ziel dieser Methode ist sowohl die Beschwerdelinderung als auch die Verhinderung des weiteren Fortschreitens der Coxarthrose.[27]
Gängige Verfahren sind:[26]
- Chiari-Osteotomie: Durchtrennung des Darmbeins oberhalb der Pfanne und Schaffung eines künstlichen Pfannendachs durch Verschiebung des Azetabulums
- Salter-Osteotomie: Durchtrennung des Darmbeins und Herunterschwenken des Pfannendachs
- Triple-Osteotomie: Durchtrennung von Darmbein, Sitzbein und Schambein und anschließend die Drehung der Hüftpfanne
Bei Deformitäten am proximalen Femur ist die intertrochantäre Derotationsvarisierungsosteotomie (DVO) Mittel der Wahl.[26]
Arthroskopie[Bearbeiten | Quelltext bearbeiten]
Die Arthroskopie des Hüftgelenks wird mittlerweile regulär bei der Behandlung des Femoroacetabulären Impingements eingesetzt, hat jedoch bei der Behandlung der Hüftgelenksarthrose nur einen begrenzten Stellenwert in der operativen Therapie[28].
Endoprothese[Bearbeiten | Quelltext bearbeiten]

Der endoprothetische Ersatz des Hüftgelenks ist die mit Abstand häufigste operative Therapiemaßnahme. Dabei werden normalerweise sowohl der Femurkopf als auch die Hüftpfanne ersetzt, man spricht daher von einer Totalendoprothese (TEP). Die Prothese kann dabei im Knochen durch Knochenzement verankert oder durch eine spezielle poröse Oberfläche ohne Zement fixiert sein. Die – ebenfalls gebräuchliche – Kombination aus zementiertem Schaft und zementfrei implantierter Pfanne wird als Hybridsystem bezeichnet. Für die Gleitpaarung können verschiedene Materialien (in der Regel: Keramik-Kopf und hochvernetzte Polyethylen-Pfanne) verwendet werden[29].
Für diese Operation werden v. a. die folgenden vier Zugänge verwendet[30]:
● Anteriorer Zugang (nach Smith-Peterson bzw. nach Hueter),
● anterolateraler Zugang (nach Watson-Jones),
● lateraler (transglutealer) Zugang (nach Bauer bzw. nach Hardinge),
● posteriorer (posterolateraler) Zugang (nach Moore).
Mittlerweile wird vermehrt auf minimalinvasive, d. h. muskel- und knochenschonende, Operationszugänge gesetzt, welche zudem ein ästhetisches Operationsergebnis versprechen[31]. Aus diesem Grund sind in den letzten Jahren auch kurze bzw. kürzere Schaftprothesen (Kurzschaftprothesen) entwickelt worden (Jerosch 2017).
Bei einem komplikationslosen Verlauf dauert eine solche Operation rund eine Stunde.
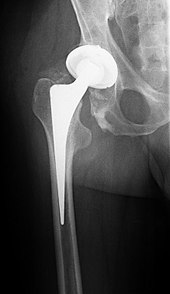
Zementfreie Prothese[Bearbeiten | Quelltext bearbeiten]
Bei der zementfreien Prothese wird die Prothese durch eine spezielle, poröse Oberfläche im Knochen verankert („pressfit“), in die der Knochen einwachsen kann. In der Regel ist eine (schmerzadaptierte) Vollbelastung nach der Operation möglich.[32]
Zementierte Prothese[Bearbeiten | Quelltext bearbeiten]
Bei einer zementierten Prothese wird der Prothesenstiel durch eine selbsthärtende Plastikmasse – Polymethylmethacrylat (PMMA) – im Femurschaft befestigt. Die Pfanne besteht in der Regel aus Polyethylen und wird ebenfalls mit PMMA fixiert. Der große Vorteil der zementierten Endoprothese liegt in der sofortigen Belastbarkeit. Deswegen ist diese Methode vor allem bei älteren Menschen (> 75 Jahren) indiziert. Nachteile gegenüber der zementierten Prothese sind die längere Operationsdauer, eine eventuelle Allergie gegen den Knochenzement sowie die Gefahr der (aseptischen) Prothesenlockerung.[32] Zudem kann es in seltenen Fällen (0,6–10 Prozent) beim Einbringen des Knochenzementes zu einer Fettembolie mit akutem Kreislaufkollaps bis hin zum Tod durch irreversiblen Herz-Kreislauf-Stillstand (0,2–0,6 Prozent) kommen. Diese oft dramatische Komplikation konnte beim Einsetzen nicht zementierter Prothesen nur in Einzelfällen beobachtet werden.[33]
Risiken/ Komplikationen[Bearbeiten | Quelltext bearbeiten]
Die Implantation eines künstlichen Hüftgelenkes ist ein großer operativer Eingriff und mit den entsprechenden Risiken verbunden:
Typische intraoperative Komplikationen sind:
- Intraoperativer Blutverlust (aber auch eine postoperative Nachblutung oder Hämatombildung) können die Gabe von Erythrozytenkonzentraten erforderlich machen. An manchen Kliniken werden Auffangsysteme verwendet, sodass das Eigenblut retransfundiert werden kann.
- Verletzungen von Nerven (insbesondere des Nervus femoralis und des Nervus ischiadicus sowie der Arteria femoralis) können durch sachgerechte Operationstechnik in aller Regel, aber nicht immer, vermieden werden. Der Nervus femoralis ist beim Zugang von vorne, der Nervus ischiadicus beim Zugang von hinten gefährdet. Meist handelt es sich jedoch nicht um eine Durchtrennung des Nervs, sondern um eine Quetschung beispielsweise durch Hakendruck; in solchen Fällen bestehen gute Aussichten auf eine vollständige Erholung des Nervs. Die Inzidenz von Nervenverletzungen wird mit circa 0,1-3,9 % angegeben[32].
- Kritische Verletzungen von Blutgefäßen sind sehr selten (circa 0,1 %)[32], aber können – insbesondere bei Perforation der A. femoralis – schlimme Folgen haben.
- Ein für den Eingriff spezifisches Risiko ist eine selten auftretende Absprengung des Trochanter major (des körpernahen Höckers des Oberschenkels), an dem unter anderen der für die Führung des Gelenkes wichtige Musculus gluteus medius ansetzt. Diese bedarf dann einer zusätzlichen Stabilisierung durch Verdrahtung oder Schrauben.
Typische postoperative Frühkomplikationen sind:
- Das Risiko für das Entstehen von tiefen Bein- oder Beckenvenenthrombosen ist relativ hoch, jedoch durch die perioperative Gabe von Blutverdünnern gut vorbeugbar. Wenn sie dennoch auftreten, können sie z. T. erhebliche Folgeschäden am betroffenen Bein (postthrombotisches Syndrom) haben sowie zu Lungenembolien führen, gelegentlich sogar mit tödlichem Ausgang.
- Bakterielle Infektionen können durch Kontamination während des Eingriffs oder auch durch Streuung von Bakterien über die Blutbahn (hämatogene Aussaat) ausgelöst werden. Die Folgen reichen von der unkomplizierten oberflächlichen Wundinfektion, die durch lokale Maßnahmen rasch zum Abklingen gebracht werden kann, bis zur tiefen Protheseninfektion, die den Ausbau der Prothese und die vorübergehende Schaffung einer Girdlestone-Situation erforderlich macht.
- Das frisch operierte Hüftgelenk hat nicht selten eine Neigung zur Ausrenkung (Luxation). Oft hilft hier die Anlage einer Orthese, welche das Bein unter Bettruhe in Innenrotation hält. Nach Stabilisierung der Gelenkkapsel im Zuge der Wundheilung und Narbenbildung wird damit weiteren Luxationen vorgebeugt.
- Die Operation kann nicht immer eine präoperative bestehende Beinlängendifferenz korrigieren bzw. kann schließlich auch zu einer Beinlängendifferenz führen, die durch entsprechende Schuhsohlenerhöhung ausgeglichen werden muss.
- Eine Implantatallergie gegen Bestandteile der Endoprothese kann ähnlich wie bei einer Infektion einen Austausch des künstlichen Gelenkes erforderlich machen (Revisionsoperation). Bei entsprechendem Verdacht kann präoperativ eine entsprechende Austestung der verwendeten Materialien erfolgen.
Typische postoperative Spätkomplikationen sind:
- Bei circa drei Prozent der Patienten wurde im Laufe von zehn Jahren eine (aseptische) Endoprothesenlockerung beobachtet, die mit Schmerzen und eventuell entzündlichen Veränderungen einhergeht und eine Revisionsoperation mit einem Wechsel der Endoprothese erforderlich machen kann.
- Ein Implantatbruch tritt nur sehr selten auf.
- Periprothetische Frakturen durch Sturz oder durch vorhergehende Lockerung der Prothese erfordern aufwändige Operationen, wo je nach Frakturmuster eine Osteosynthese oder ein Ersatz der Prothese erfolgt.
- Späte periprothetische Infektionen, entweder direkt (z. B. nach Infiltration oder Revisionsoperation) oder indirekt (über die Blutbahn).
- Bei einigen Patienten tritt in den ersten Monaten nach der Operation eine heterotope Knochenbildung, eine periartikuläre Ossifikation auf. Ohne geeignete Gegenmaßnahmen kann durch sie die – durch die Operation gewonnene – Beweglichkeit wieder eingeschränkt werden. Die postoperative Gabe eines geeigneten Entzündungshemmers, wie z. B. Ibuprofen für zwei Wochen postoperativ, ist aus dem diesem Grund Standard für fast alle Patienten. Bei Risikopatienten (z. B. Niereninsuffizienz) kann alternativ eine vorbeugende Röntgen-Bestrahlung des umliegenden Gewebes unmittelbar vor der Operation (durchschnittlich mit 7 Gy mittels eines Linearbeschleunigers) erfolgen.[34]
Prognose[Bearbeiten | Quelltext bearbeiten]
Besonders die endoprothetische Versorgung hat eine sehr gute Langzeitprognose, circa 95 Prozent der implantierten Endoprothesen sind auch nach 10 Jahren noch funktionstüchtig. Gemäß dem Swedish Hip Arthroplasty Register mussten selbst nach 26 Jahren 75 Prozent der Hüftendoprothesen nicht ausgetauscht werden. Derselben Studie zufolge ist auch eine erneute Wechseloperation (Re-Revision) kaum wahrscheinlicher als eine Revision, denn nach zehn Jahren sind – statistisch – immer noch mehr als 80 Prozent der Zweitprothesen in situ.[35]
Qualitätssicherung/ Register[Bearbeiten | Quelltext bearbeiten]
Daten zu Hüft-TEP-Implantationen werden in lokalen, regionalen und nationalen Registern erfasst. In Schweden wurde bereits 1979 ein nationales Register eingeführt, wo alle Operationen verzeichnet werden. Mittlerweile gibt es solche Register auch im deutschsprachigen Raum, wobei in Deutschland nur die Daten der Ersatzkassen analysiert werden (EPRD 2023). Aktuell stellt die Verbesserung des internen wie externen Qualitätsmanagements einen wichtigen Trend in Deutschland dar. So können sich orthopädische Kliniken mittels des EndoCert-System als Endoprothetikzentrum (EPZ) bzw. als Endoprothetikzentrum der Maximalversorgung (EPZmax) zertifizieren lassen.[1]
Kosten[Bearbeiten | Quelltext bearbeiten]
Arthrosen sind mit erheblichen Kosten für das Gesundheitssystem verbunden. Erkrankungen des Muskel-Skelett-Systems bildeten im Jahr 2008 mit 28,55 Mrd. € (11,2 % der Gesamtkosten), nach den Erkrankungen des Kreislaufsystems (2008: 36,97 Mrd. €, entspricht 14,5 %) und den Erkrankungen des Verdauungssystems (34,81 Mrd. €, entspricht 13,7 %), den drittgrößten Kostenfaktor für Behandlungen von Erkrankungen in Deutschland. Dabei verursachte die Behandlung von Arthrose 7,62 Mrd. € (Stand 2004). Über 96 Prozent der Kosten entfielen auf Menschen ab 45 Jahren, etwa zwei Drittel (67,8 Prozent) auf Personen ab 65 Jahren.[36]
Die Behandlungskosten für den endoprothetischen Hüftgelenksersatz werden gemäß der geltenden Fallpauschalen und Sonderentgelte vergütet. Diese werden in Punktwerten angegeben, wobei Fallpauschalen die gesamten Behandlungskosten (einschließlich Operation und Krankenhausaufenthalt) und Sonderentgelte lediglich die operative Leistung abdecken. Die Gesamtpunkte errechnen sich aus der Summe der Punkte für Personal und der Punkte für Sachmittel. Für diese werden bundesweit länderspezifische Multiplikationsfaktoren vereinbart, um die jeweilige Vergütung zu errechnen.
In Österreich werden die Kosten einer Prothese oder Endoprothese, sofern der Hüftgelenksersatz medizinisch indiziert ist, nur im Allgemeinen, öffentlichen Krankenhaus vollständig von der jeweiligen Krankenkasse getragen. Bei anderen Operationseinrichtungen können die Krankenkassen die Kostenübernahme ablehnen. [37]
Hüftgelenksarthrose bei Haustieren[Bearbeiten | Quelltext bearbeiten]
Hüftgelenksarthrosen sind sehr häufig bei Haushunden und Hauskatzen zu beobachten: Bei Hunden treten solche Erkrankungen häufig im Zusammenhang mit der Hüftdysplasie (HD) als Alterserscheinung auf.[38] Studien (Stand 2013) zeigten, dass fast 90 Prozent der älteren Hauskatzen an einer Hüftgelenksarthrose leiden, bei einem Körpergewicht von über 6 kg sogar alle Tiere.[39]
Literatur[Bearbeiten | Quelltext bearbeiten]
Leitlinien[Bearbeiten | Quelltext bearbeiten]
- S2k-Leitlinie Koxarthrose der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie (DGOU). In: AWMF online (Stand 2019)
- S3-Leitlinie Indikationskriterien zur Hüfttotalprothese bei Coxarthrose der Deutschen Gesellschaft für Orthopädie und Unfallchirurgie (DGOU). In: AWMF online (Stand 2021)
Registerdaten[Bearbeiten | Quelltext bearbeiten]
- Endoprothesenregister Deutschland (EPRD): Jahresbericht 2023. ISBN 978-3-949872-02-0.
Übersichtsarbeiten[Bearbeiten | Quelltext bearbeiten]
- Joachim Grifka, Jürgen Krämer (Hrsg.): Orthopädie Unfallchirurgie. 9. Auflage. Springer Verlag, Berlin 2013, ISBN 978-3-642-28874-6.
- N. Wülker et al.: Taschenlehrbuch Orthopädie und Unfallchirurgie, 1. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 3-13-129971-1.
- M. Müller et al.: Chirurgie für Studium und Praxis, 9. Auflage. Medizinische Verlags- und Informationsdienste, Breisach a. Rh. 2009, ISBN 3-929851-08-3. S. 380ff.
Spezialliteratur[Bearbeiten | Quelltext bearbeiten]
- François Françon: Coxarthrose (= Acta rheumatologica. Nr. 9). Geigy, Basel (Juni) 1956.
- D. Lühmann, B. Hauschild, H. Raspe: Hüftgelenkendoprothetik bei Osteoarthrose – Eine Verfahrensbewertung, Institut für Sozialmedizin, Medizinische Universität zu Lübeck, Nomos Verlagsgesellschaft, Lübeck 2000, ISBN 3-7890-7039-4.
- J. Duparc et al.: Beckenring und Hüfte (= Chirurgische Techniken in Orthopädie und Traumatologie. Band 6). Lehmanns Sonderausgabe, Urban & Fischer Verlag, München 2005, ISBN 3-86541-286-6.
- H. I. Roach, S. Tilley: The Pathogenesis of Osteoarthritis. In: F. Bronner, M. C. Farach-Carson (Hrsg.): Bone and Osteoarthritis. Band 4. Springer Verlag, 2007, ISBN 1-84628-513-5, S. 1–19.
- Jörg Jerosch (Hrsg.): Kurzschaftendoprothesen an der Hüfte. Springer, Berlin / Heidelberg 2017, ISBN 978-3-662-52743-6.
- Henning Windhagen, Jens Gronewold, Stefan Budde: Koxarthrose. In: Dieter Christian Wirtz, Ulrich Stöckle (Hrsg.): Hüfte. Expertise Orthopädie und Unfallchirurgie. Georg Thieme, Stuttgart 2018, ISBN 978-3-13-201071-0, S. 237–264.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Henning Windhagen, Jens Gronewold, Stefan Budde: Koxarthrose. In: Dieter Christian Wirtz, Ulrich Stöckle (Hrsg.): Hüfte. Expertise Orthopädie und Unfallchirurgie. Georg Thieme, Stuttgart 2018, ISBN 978-3-13-201071-0, S. 237–264, hier: S. 259–260: Qualitätssicherung in der Endoprothetik.
- ↑ Lühmann et al., 2000, S. 10.
- ↑ Jörg Jerosch (Hrsg.): Kurzschaftendoprothesen an der Hüfte. Springer, Berlin / Heidelberg 2017, ISBN 978-3-662-52743-6.
- ↑ EPRD 2023, S. 13.
- ↑ Lühmann et al., 2000, S. 8
- ↑ Windhagen et al., 2018, S. 237.
- ↑ a b c d Grifka / Krämer 2013: Hüftregion. S. 289–325.
- ↑ a b Wülker, 2005, S. 13.
- ↑ Müller, 2009, S. 382
- ↑ Wülker, 2005, S. 14
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Jahresbericht 2020 des IFA. Abgerufen am 17. Mai 2022.
- ↑ Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA): Berufskrankheiten-Verordnung – hier: Empfehlung des Ärztlichen Sachverständigenbeirats „Berufskrankheiten“ - Koxarthrose durch Lastenhandhabung - Bek. d. BMAS v. 25.03.2020 - IVa 4-45226-2 - KoxarthroseGMBl. 25.03.2020, 218-227: Berufskrankheiten-Verordnung – hier: Empfehlung des Ärztlichen Sachverständigenbeirats „Berufskrankheiten“ - Koxarthrose durch Lastenhandhabung - Bek. d. BMAS v. 25.03.2020 - IVa 4-45226-2 - KoxarthroseGMBl. 25.03.2020, 218-227. Abgerufen am 17. Mai 2022.
- ↑ Lühmann et al., 2000, S. 11–12; vgl. Günther et al.: Klinische Epidemiologie von Hüft- und Kniegelenkarthrosen: Eine Übersicht über Ergebnisse der Ulmer Osteoarthrose-Studie. In: Zeitschrift für Rheumatologie. Band 61, Nr. 3, 2002, S. 244–249.
- ↑ Wülker, 2005, S. 1
- ↑ Robert Merle d’Aubigné, M. Postel: Functional results of hip arthroplasty with acrylic prosthesis. In: The Journal of Bone & Joint Surgery. Jahrgang 36-A, Heft 3, 1954, S. 451–475. PMID 18941852.
- ↑ DGOOC Leitlinie, Kap. 6
- ↑ R. Altman et al.: The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip. In: Arthritis Rheum., 2001, 44(10):, S. 2449–2450.
- ↑ Wülker, 2005, S. 17.
- ↑ a b Lühmann et al., 2000, S. 13–14; vgl. Sun et al.: Inzidenz und Prävalenz der Cox- und Gonarthrose in der Allgemeinbevölkerung. In: Zeitschrift für Orthopädie. Band 1997, S. 184–192.
- ↑ Croft et al.: Defining osteoarthritis of the hip for epidemiologic studies. In: American Journal of Epidemiology. Band 132, Nr. 3, 1990, S. 514–522.
- ↑ Wülker, 2005, S. 18ff
- ↑ Wülker, 2005, S. 223
- ↑ Windhagen et al. 2018: Konservative Therapie, S. 245–247.
- ↑ Jörg Jerosch: Wie effektiv ist die Injektionsbehandlung im Bereich des Hüftgelenks? In: OUP 2020, S. 43-46 ([1]), abgerufen am 27. März 2024.
- ↑ Windhagen et al. 2018, S. 238.
- ↑ a b c Wülker, 2005, S. 19–22. Millis et al.: Osteotomies about the hip in the prevention and treatment of osteoarthritis. In: Instructional Course Lectures, 1992, 41, S. 145–54
- ↑ Windhagen et al. 2018, S. 248–250.
- ↑ Windhagen et al. 2018, S. 247–248.
- ↑ EPRD 2023, S. 32.
- ↑ Windhagen et al. 2018, S. 239–242.
- ↑ Joachim Pfeil, Werner Siebert: Minimally Invasive Surgery in Total Hip Arthroplasty. Springer, Berlin 2010,
- ↑ a b c d Windhagen et al.: Hüftendoprothetik. 2018, S. 250–258.
- ↑ N. Aebli, R. Pitto, J. Krebs: Fettembolie – eine potentiell tödliche Komplikation während orthopädischen Eingriffen. In: Schweiz Med Forum. Nr. 5, 2005, S. 512–518 (medicalforum.ch [PDF; 295 kB; abgerufen am 26. Juni 2011]).
- ↑ J. Seufert: Präoperative Bestrahlung zur Prävention heterotoper Ossifikation nach Hüftgelenksendoprothese. Dissertation, Medizinische Fakultät der Universität Würzburg, Würzburg 2004, S. 83ff., uni-wuerzburg.de (PDF; 292 kB) abgerufen am 28. Juni 2011.
- ↑ Annual Report 2005. The Swedish Hip Arthroplasty Register orthop.gu.se (Memento vom 28. April 1999 im Internet Archive)
- ↑ Gesundheit. Krankheitskosten. 2002, 2004, 2006 und 2008. (Memento vom 15. November 2012 im Internet Archive) Statistisches Bundesamt, Wiesbaden 2010; abgerufen am 5. Juli 2011
- ↑ Kostenübernahme bei Hüftgelenksersatz. In: Salzburger Gebietskrankenkasse. Abgerufen am 8. Februar 2019.
- ↑ Bernd Tellhelm, Ottmar Distl, Antje Wigger: Hüftgelenksdysplasie (HD) – Entstehung, Erkennung, Bekämpfung. In: Kleintierpraxis. Band 53, Nr. 4, 2008, S. 246–260.
- ↑ Angelika Drensler: Prävalenz feliner degenerativer Gelenkerkrankungen im Röntgen. In: Kleintierpraxis. Band 58, 2013, S. 289–298.