Serin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
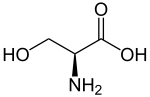
| ||||||||||||||||||||||
| Abbildung des natürlich vorkommenden L-Serins | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Serin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H7NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße, nadelförmige, süßlich schmeckende Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 105,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,6 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Serin, abgekürzt Ser oder S, ist in der L-Konfiguration [(S)-Konfiguration] eine proteinogene, nicht-essentielle α-Aminosäure. Es ist benannt nach der Isolierung aus Seidenprotein, von lateinisch sericum "Seide".[4]
Isomere[Bearbeiten | Quelltext bearbeiten]
Serin besitzt ein stereogenes Zentrum und hat damit zwei Enantiomere, die D-Aminosäure D-Serin [Synonym: (R)-Serin] und ihr Spiegelbild, das „natürliche“ L-Serin. Das Racemat DL-Serin [Synonym: (RS)-Serin] besteht zu gleichen Teilen aus L-Serin und D-Serin. Wenn in der wissenschaftlichen Literatur Serin ohne jeden weiteren Zusatz (Präfix) genannt wird, ist fast immer L-Serin gemeint.
| Isomere von Serin | ||
| Name | L-Serin | D-Serin |
| Andere Namen | (S)-Serin | (R)-Serin |
| Strukturformel |  |
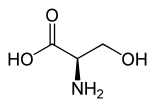
|
| CAS-Nummer | 56-45-1 | 312-84-5 |
| 302-84-1 (unspez.) | ||
| EG-Nummer | 200-274-3 | 206-229-4 |
| 206-130-6 (unspez.) | ||
| ECHA-Infocard | 100.000.250 | 100.005.665 |
| 100.005.574 (unspez.) | ||
| PubChem | 5951 | 71077 |
| 617 (unspez.) | ||
| DrugBank | DB00133 | DB03929 |
| – (unspez.) | ||
| FL-Nummer | 302-84-1 (D,L) | |
| Wikidata | Q183290 | Q27077119 |
| Q26997410 (unspez.) | ||
L-Serin racemisiert (partiell) leichter als andere proteinogene L-Aminosäuren. Deshalb enthalten viele L-Serin-Präparate geringe Mengen (0,5 bis 3 %) D-Serin.
Vorkommen[Bearbeiten | Quelltext bearbeiten]

Serin wurde erstmals 1865 von Emil Cramer aus Seidenprotein isoliert.[4] Genauer aus dem Seidenbast, auch Sericin genannt, der leimartig in der Rohseide die Fibroinfäden verklebt und beim Entbasten entfernt wird. Dieser umhüllende Bast des seidenen Fadens, den die Larve des Seidenspinners (Bombyx mori) zum Kokon spinnt, besteht zu einem Drittel aus Serin.
Als proteinogene Aminosäure ist L-Serin ein Baustein zahlreicher verschiedener Proteine. So macht es beispielsweise in Kollagenen, den häufigsten Faserproteinen der extrazellulären Matrix im Gewebe von Säugetieren und Fischen, ungefähr ein Zwanzigstel aus.[6][7][8] Eine besondere Rolle spielt die Seitenkette eines Serins im aktiven Zentrum bestimmter enzymatisch wirksamer Proteine, der Serinproteasen. Hierzu gehören nicht nur Verdauungsenzyme wie die Trypsine und Chymotrypsine, sondern auch das für die Blutgerinnung wichtige Thrombin ebenso wie das Plasmin, das Fibrin spaltet. Auch die im zentralen und peripheren Nervensystem wirkende Acetylcholinesterase – zerlegt den Neurotransmitter Acetylcholin – enthält einen Serinrest in der katalytischen Triade ihres aktiven Zentrums.
Daneben ist Serin eine wesentliche Komponente von Phosphatidylserinen, einer Gruppe der Phosphoglyzeride in der Lipiddoppelschicht der Zellmembran.
Das Enantiomer D-Serin ist eine beim Menschen natürlich vorkommende D-Aminosäure und wird mithilfe einer Racemase aus L-Serin gebildet. Das D-Serin stellt einen Signalstoff von Nervenzellen dar und wirkt neuromodulatorisch als Ligand am NMDA-Rezeptor durch Bindung an Stelle von Glycin, stärker als dieses.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Serin liegt bei neutralem pH-Wert überwiegend als Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:

Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Serin auch seine geringste Löslichkeit in Wasser hat. Der isoelektrische Punkt von Serin liegt bei 5,68.[10]
Genauso wie alle Aminosäuren mit einer (hydrophilen) OH-Gruppe (Hydroxygruppe) kann Serin phosphoryliert werden und spielt somit bei der Aktivierung bzw. Inaktivierung von Enzymen eine wichtige Rolle. Außerdem befindet sie sich häufig im aktiven Zentrum von Enzymen und spielt daher für die Biokatalyse eine wichtige Rolle: Beispiele dafür sind die Serinproteinasen und ihre Inhibitoren, die Serpine (Serinproteinasen-Inhibitoren).
Biosynthese und Abbau[Bearbeiten | Quelltext bearbeiten]
Für Biosynthese und Abbau inklusive Strukturformeln siehe Abschnitt Weblinks.
Durch Oxidation und folgende Transaminierung ausgehend von 3-Phosphoglycerat wird Serin synthetisiert. Im Körper wird Serin zu Glycin abgebaut, es kann jedoch auch in einer PALP-abhängigen, eliminierenden Desaminierung durch die Serin-Dehydratase zu Pyruvat umgewandelt werden.
Technische Herstellung[Bearbeiten | Quelltext bearbeiten]
Industriell wird L-Serin durch Fermentation hergestellt, in einer geschätzten Menge von 100–1000 Tonnen pro Jahr.[11] Alternativ können keratinhaltige Proteine mit Salzsäure hydrolysiert und mit Ammoniak neutralisiert werden. Das so erhaltene Gemisch von ca. 20 proteinogenen Aminosäuren (eine davon ist das L-Serin) wird aufgrund unterschiedlicher Löslichkeiten und mittels Ionenaustauscherchromatographie getrennt. Die einzelnen Fraktionen werden durch Umkristallisation gereinigt.
D-Serin[Bearbeiten | Quelltext bearbeiten]
In Gliazellen und Neuronen wird D-Serin durch das Enzym Serin-Racemase gebildet. An NMDA-Rezeptoren fungiert D-Serin als endogener Co-Agonist, es bindet an der NR1-Untereinheit und erhöht die Affinität von Glutamat an diesem Rezeptor.[12] Es gibt Hinweise darauf, dass ein physiologischer Mangel an D-Serin eine Rolle im Depressionsgeschehen spielen könnte.[13]
In einigen Pflanzen ist die Serin-Racemase in Stempel und Samenanlagen nachgewiesen und spielt dort eine Rolle in der Navigation des einwachsenden Pollenschlauchs. L-Serin wird dabei zu D-Serin umkonfiguriert und vom Pollenschlauch erkannt. GLR-Gene (Glutamate receptor-like genes) bilden im Pollenschlauch Ca2+-Kanäle, die durch D-Serin aktiviert werden, dadurch entsteht ein oszillierendes Ca2+-Signal in der Pollenschlauchspitze, das das Wachstum fördert und richtet. Pollenschläuche, in denen dieser Signalweg gestört wurde, zeigen deformiertes Wachstum, verzweigen sich und sind weniger fertil.[14]
Dieser pflanzliche Signalmechanismus ist insofern interessant, als die Aminosäure-vermittelte Kommunikation bislang eher mit dem zentralen Nervensystem der höheren Tiere in Zusammenhang gebracht wurde.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu L-Serin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- ↑ a b c d Eintrag zu Serin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. November 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Serin bei Merck, abgerufen am 14. März 2010.
- ↑ a b Ueber die Bestandtheile der Seide. In: Archiv der Pharmazie. Band 183, Nr. 1-2, Januar 1868, S. 187–189, doi:10.1002/ardp.18681830194.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2, S. 470.
- ↑ P. Szpak: Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis. In: Journal of Archaeological Science. Band 38, Nr. 12. Elsevier, Dezember 2011, S. 3358–3372, doi:10.1016/j.jas.2011.07.022.
- ↑ J. E. Eastoe: The amino acid composition of mammalian collagen and gelatin. In: Biochemical Journal. Band 61, Nr. 4, 1955, S. 589–600, doi:10.1042/bj0610589, PMID 13276342, PMC 1215839 (freier Volltext).
- ↑ J. E. Eastoe: The amino acid composition of fish collagen and gelatin. In: Biochemical Journal. Band 65, Nr. 2, 1957, S. 363–368, doi:10.1042/bj0650363, PMID 13403916, PMC 1199877 (freier Volltext).
- ↑ J. Mothet, A. Parent, H. Wolosker, R. Brady, D. Linden, C. Ferris, M. Rogawski, S. Snyder: D-serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor. In: Proceedings of the National Academy of Sciences of the United States of America. Band 97, Nr. 9, April 2000, S. 4926–4931; doi:10.1073/pnas.97.9.4926. PMID 10781100, PMC 18334 (freier Volltext).
- ↑ P. M. Hardy: The Protein Amino Acids. In: G. C. Barrett (Hrsg.): Chemistry and Biochemistry of the Amino Acids. Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ K. Drauz, I. Grayson, A. Kleemann, H.-P. Krimmer, W. Leuchtenberger, C. Weckbecker: Amino Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2012, doi:10.1002/14356007.a02_057.pub2.
- ↑ L. Pollegioni, S. Sacchi: Metabolism of the neuromodulator D-serine. In: Cell. Mol. Life Sci. Band 67, Nr. 14, 2010, S. 2387–2404, doi:10.1007/s00018-010-0307-9, PMID 20195697.
- ↑ O. Malkesman, D. R. Austin, T. Tragon u. a.: Acute D-serine treatment produces antidepressant-like effects in rodents. In: Int. J. Neuropsychopharmacol. Band 15, Nr. 8, 2012, S. 1135–1148, doi:10.1017/S1461145711001386, PMID 21906419.
- ↑ Erwan Michard, Pedro T. Lima, Filipe Borges, Ana Catarina Silva, Maria Teresa Portes: Glutamate Receptor–Like Genes Form Ca2+ Channels in Pollen Tubes and Are Regulated by Pistil d-Serine. In: Science. Band 332, Nr. 6028, 22. April 2011, S. 434–437, doi:10.1126/science.1201101, PMID 21415319 (sciencemag.org [abgerufen am 11. November 2016]).