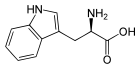
Tryptophan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Abbildung von L-Tryptophan, der natürlich vorkommenden Form | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tryptophan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C11H12N2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis beigefarbener Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
| |||||||||||||||||||||
| Wirkmechanismus |
Hormonvorstufe, Nahrungsmittel | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 204,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Siedepunkt |
281–282 °C (Sublimation bei 0,4 hPa)[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Tryptophan, abgekürzt Trp oder W, ist in der L-Form (siehe Fischer-Projektion) eine proteinogene α-Aminosäure mit einem aromatischen Indol-Ringsystem. Gemeinsam mit Phenylalanin, Tyrosin und Histidin zählt Tryptophan daher zu den aromatischen Aminosäuren. Es gehört zu den essentiellen Aminosäuren, kann also vom menschlichen Körper nicht gebildet werden und muss mit der Nahrung zugeführt werden. Es ist benannt nach den Verdauungsenzymen Trypsin, mit deren Hilfe es aus dem Protein Casein isoliert wurde.[6] Im Einbuchstabencode wurde für Tryptophan W zugeordnet, da der Doppelring optisch an den sperrigen Buchstaben erinnert.[7]
Isomere[Bearbeiten | Quelltext bearbeiten]
Tryptophan besitzt ein Stereozentrum, somit existieren zwei Enantiomere. Die natürlich Vorkommende Form wird als L-Tryptophan [Synonym: (S)-Tryptophan] bezeichnet. Das Enantiomer D-Tryptophan (Spiegelbild von L-Tryptophan) und das Racemat (1:1-Gemisch aus D- und L-Form) besitzen nur eine geringe Bedeutung. Wird in diesem Artikel oder in der Literatur „Tryptophan“ ohne weiteren Namenszusatz (Präfix) erwähnt, ist L-Tryptophan gemeint.
| Isomere von Tryptophan | ||
| Name | L-Tryptophan | D-Tryptophan |
| Andere Namen | (S)-Tryptophan | (R)-Tryptophan |
| Strukturformel |  |
|
| CAS-Nummer | 73-22-3 | 153-94-6 |
| 54-12-6 (unspez.) | ||
| EG-Nummer | 200-795-6 | 205-819-9 |
| 200-194-9 (unspez.) | ||
| ECHA-Infocard | 100.000.723 | 100.005.292 |
| 100.000.178 (unspez.) | ||
| PubChem | 6305 | 9060 |
| 1148 (unspez.) | ||
| DrugBank | DB00150 | DB03225 |
| − (unspez.) | ||
| Wikidata | Q181003 | Q27077125 |
| Q27103394 (unspez.) | ||
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Aminosäuren kommen natürlich vor allem in Proteinen gebunden vor; ungebundene Aminosäuren kommen zwar auch immer vor, jedoch in vergleichsweise geringen Mengen, nur gelegentlich bis zu einigen Prozent der Gesamtmenge an Aminosäuren.[8] Tryptophan ist Bestandteil von Proteinen und Peptiden. Da der menschliche Organismus nicht in der Lage ist, diese Aminosäure herzustellen, ist er auf die Zufuhr mit der Nahrung angewiesen. Viele Nahrungsmittel enthalten L-Tryptophan als Proteinbestandteil. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Tryptophan am Gesamtprotein angegeben:[9]
| Lebensmittel | Protein | Tryptophan | Anteil |
|---|---|---|---|
| Sojabohnen | 36,49 g | 590 mg | 1,6 % |
| Cashew-Kerne | 18,22 g | 287 mg | 1,6 % |
| Kakaopulver, ungesüßt | 19,60 g | 293 mg | 1,5 % |
| Haferflocken | 13,15 g | 182 mg | 1,4 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 46 mg | 1,4 % |
| Reis, ungeschält | 7,94 g | 101 mg | 1,3 % |
| Hühnerei | 12,57 g | 167 mg | 1,3 % |
| Hähnchenbrustfilet, roh | 21,23 g | 267 mg | 1,3 % |
| Erbsen, getrocknet | 24,55 g | 275 mg | 1,1 % |
| Walnüsse | 15,23 g | 170 mg | 1,1 % |
| Schweinefleisch, roh | 20,95 g | 220 mg | 1,1 % |
| Lachs, roh | 20,42 g | 209 mg | 1,0 % |
| Mais-Vollkornmehl | 6,93 g | 49 mg | 0,7 % |
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Das natürliche L-Tryptophan schmeckt bitter, das nicht natürliche D-Tryptophan hingegen süß.[8]
Die Aminosäuren-Seitenkette von Tryptophan ist lipophil und aromatisch. Daher ist es schlecht wasserlöslich. Sein isoelektrischer Punkt liegt bei 5,89, der pKCOOH ist 2,4, der pKNH2 9,3 (beide bei 25 °C).
Tryptophan ist oxidationsempfindlich. Es lässt sich unter vergleichsweise milden Bedingungen, beispielsweise durch Dimethylsulfoxid (DMSO) in Salzsäure, zu 2-Hydroxytryptophan oxidieren.[10]
Das Van-der-Waals-Volumen von Tryptophan ist 163 und der Hydrophobizitätsgrad −0,9. Freies Tryptophan als auch proteingebundene Tryptophan-Einheiten fluoreszieren unter Ultraviolettstrahlung. Bei Anregung mit UV-Licht mit einer Wellenlänge von 280 nm erfolgt die Fluoreszenzemission zwischen 308 und 350 nm abhängig von der Polarität der direkten Umgebung von Tryptophan. Falls in Proteinen Tryptophan-Einheiten vorhanden sind, überdeckt die Fluoreszenz von Tryptophan die Fluoreszenz der übrigen aromatischen Aminosäuren (Tyrosin, Phenylalanin).
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Pflanzen und Mikroorganismen können L-Tryptophan herstellen, unter anderem aus der Shikimisäure über den Shikimisäureweg, wobei das Enzym Anthranilat-Synthase (EC 4.1.3.27) die Umwandlung von Chorismat in Anthranilat katalysiert.[11] Letzteres kondensiert mit Phosphoribosylpyrophosphat (PRPP) unter Abspaltung von Diphosphat zu N-(5-Phosphoribosyl)-anthranilat (durch Anthranilat-phosphoribosyl-Transferase, EC 2.4.2.18). Nach isomerer Umlagerung des Riboseanteils (durch die Phosphoribosylanthranilat-Isomerase, EC 5.3.1.24) folgt unter Einfluss der Indol-3-glycerolphosphat-Synthase (EC 4.1.1.48) mit Decarboxylierung der Ringschluss zu Indol-3-glycerolphosphat. In den beiden letzten Schritten wird Indol abgespalten, und aus diesem dann mit L-Serin das L-Tryptophan gebildet, beidenfalls katalysiert durch die Tryptophan-Synthase (EC 4.2.1.20).

Bei einem Bakterium wie E. coli wird die zelluläre Tryptophan-Synthese über das trp-Operon kontrolliert, in welchem nach einem regulatorischen Bereich – hier für Repression und auch für Attenuation (siehe auch Attenuation am Beispiel des Tryptophan) – die Segmente der Gene trpE, G-D, C-F, B und A aufeinanderfolgen. Diese werden gemeinsam als polycistronische mRNA transkribiert und führen in Polypeptide translatiert zur Bildung der teils heterotetramer assoziierten Proteine. Diese Multienzymkomplexe entfalten je entsprechend ihren Untereinheiten die Wirksamkeit von Anthranilat-synthase (trp-E und trp-G) und Anthranilat-phosphoribosyl-transferase (trp-D), Phosphoribosyl-anthranilat-isomerase (trp-F) und Indol-glycerolphosphat-synthase (trp-C), sowie Tryptophan-synthase (trp-A und trp-B).[12]
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 3,5 bis 6 mg Tryptophan pro Kilogramm Körpergewicht.[13] Es gibt Hinweise darauf, dass der Tryptophan-Bedarf individuell sehr verschieden ausfallen kann.[14]
Das Codon UGG codiert die Aminosäure Tryptophan.
- L-Tryptophan ist am Aufbau von diversen Proteinen im menschlichen Körper beteiligt, z. B. in den Muskeln, im Apolipoprotein B100 (Teil des Cholesterin-Transportmoleküls LDL) oder in Enzymen.
- Es dient als Vorläufer für verschiedene Botenstoffe (Neurotransmitter, Hormone) wie Serotonin und Melatonin.
- L-Tryptophan ist Provitamin für Vitamin B3.
Serotoninsynthese (Mensch)[Bearbeiten | Quelltext bearbeiten]

L-Tryptophan wird durch das Enzym Tryptophan-Hydroxylase (TPH, EC 1.14.16.4) in 5-Hydroxytryptophan (5-HTP) überführt. Die Tryptophanhydroxylase kann durch eine Reihe an Faktoren gehemmt werden, so z. B. durch Vitamin-B6- / Vitamin-B3-Mangel, Insulinresistenz, Magnesiummangel, aber auch durch Stress. Da der Übergang vom L-Tryptophan zum 5-HTP bei der körpereigenen Serotoninsynthese der geschwindigkeitsbestimmende Schritt ist, kommt der Tryptophan-Hydroxylase eine wichtige Regelfunktion dieses Syntheseweges zu.
5-HTP (auch bekannt unter dem Namen Oxitriptan) wird durch das Enzym Hydroxytryptophan-Decarboxylase (genauer: Aromatische-L-Aminosäure-Decarboxylase, AADC, EC 4.1.1.28) in Serotonin überführt. Das Vitamin-B6-Derivat Pyridoxalphosphat wirkt dabei als Cofaktor und verstärkt (oder vermindert) in Abhängigkeit seines Vorhandenseins die Aktivität der Hydroxytryptophan-Decarboxylase.[15]
Abbau von Tryptophan[Bearbeiten | Quelltext bearbeiten]
Der Abbau von L-Tryptophan erfordert die Spaltung beider aromatischer Ringe, was durch Oxygenasen katalysiert wird. Dabei wird durch die Tryptophan-2,3-Dioxygenase zunächst der Pyrrolring aufgebrochen, wodurch über die Abspaltung von Ameisensäure (mithilfe der Arylformamidase) Kynurenin entsteht. Dieses wird durch die Kynurenin-3-Monooxygenase (EC 1.14.13.9), zu 3-Hydroxykynurenin umgesetzt. Cofaktor ist dabei FAD, Cosubstrate sind molekularer Sauerstoff und NADPH. Nach Abspaltung von Alanin (mittels Kynureninase) katalysiert eine weitere Dioxygenase, die 3-Hydroxyanthranilat-3,4-Dioxygenase, die Spaltung des verbliebenen Aromatenrings, so dass nach mehreren Reaktionsschritten schließlich Acetacetat vorliegt. Der instabile Aldehyd, der nach Anwendung der zweiten Dioxygenase entsteht und sich spontan in Chinolinat umwandelt, wird teilweise bei der NAD-Biosynthese verwendet.

Mehrere der beim Abbau beteiligten Enzyme scheinen bei Ratten im Alter an Aktivität zu verlieren.[16]
Bei der Oxidation von Tryptophan oder Tryptophan-Einheiten von Proteinen durch Photooxidation oder Sauerstoffradikale entsteht eine Vielzahl von Oxidationsprodukten, die bisher noch nicht alle identifiziert werden konnten.
Tryptophan und Immunsystem[Bearbeiten | Quelltext bearbeiten]
Indolamin-2,3-Dioxygenase (IDO) ist ein Isoenzym der Tryptophan-2,3-Dioxygenase (Tryptophan-Pyrrolase), das während einer Immunreaktion aktiviert wird, um die Verfügbarkeit von Tryptophan für z. B. virusinfizierte Zellen oder Krebszellen und damit deren Wachstum einzuschränken. Aus diesem Grund werden im Blut von Patienten mit solchen Erkrankungen auch verminderte Tryptophanspiegel mit einer gleichzeitig gesteigerten Abbaurate beobachtet: je stärker die Tryptophanverminderung beim Patienten ausgeprägt ist, desto größer ist auch die Wahrscheinlichkeit einer kürzeren Überlebenszeit. Die verminderte Tryptophanverfügbarkeit ist aber auch mit ein Grund für eine gesteigerte Depressionsneigung bei diesen Patienten.[17]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Racemisches Tryptophan kann beispielsweise ausgehend von Acrolein und einem Acetamidomalonsäureester hergestellt werden. Der daraus gebildete Aldehyd wird mit Phenylhydrazin in das entsprechende Phenylhydrazon umgewandelt. Entsprechend der Fischerschen Indolsynthese wird daraus die Indol-Einheit aufgebaut. Durch eine Verseifung werden die N-Acetylgruppe entfernt und beide Ester gespalten. Durch Decarboxylierung entsteht Tryptophan. Biotechnologisch kann L-Tryptophan sowohl durch Bakterien als auch durch Hefen hergestellt werden.[18]
Industrielle Synthese[Bearbeiten | Quelltext bearbeiten]
Die industrielle Produktion von L-Tryptophan geschieht ebenfalls biosynthetisch aus L-Serin und Indol und nutzt dazu eine Wildtypmutante von Escherichia coli. Die Umsetzung wird dabei durch das Enzym Tryptophansynthase katalysiert.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Nahrungsergänzung/Ernährung[Bearbeiten | Quelltext bearbeiten]
Als Bestandteil von Nährlösungen zur parenteralen Ernährung findet L-Tryptophan, neben anderen Aminosäuren, breite Anwendung. Die essentiellen Aminosäuren inklusive Tryptophan sind in solchen Lösungen immer enthalten.[19]
Als schlichte Nahrungsergänzung ist L-Tryptophan nur bei gesichertem Mangel sinnvoll, der in Industrieländern praktisch unbekannt ist. Bei einer Fruktosemalabsorption ist jedoch ein signifikant erniedrigter Serumtryptophanspiegel beobachtet worden.[20] Der Spiegel dieser essentiellen L-Aminosäure in der Nährflüssigkeit des Gehirns ist nicht beliebig durch Verzehr entsprechend eiweißhaltiger Nahrung einstellbar, denn L-Tryptophan konkurriert mit fünf anderen Aminosäuren an der Blut-Hirn-Schranke um das Eindringen in die Nährflüssigkeit des Gehirns; nämlich mit den verzweigtkettigen (das sind L-Valin, L-Leucin und L-Isoleucin) und zwei aromatischen (L-Phenylalanin und L-Tyrosin) Aminosäuren.[21]
Verwendung als Antidepressivum[Bearbeiten | Quelltext bearbeiten]
Die Wirkung von L-Tryptophan wird oft als stimmungsaufhellend, beruhigend und gewichtsreduzierend beschrieben. L-Tryptophan gilt als „natürliches Antidepressivum“, ihm wird eine gewisse Wirksamkeit bei depressiven Erkrankungen bei gleichzeitig geringen Nebenwirkungen nachgesagt. Wissenschaftliche Belege einer Wirkung durch zusätzliche Tryptophangaben (z. B. als Nahrungsergänzungsmittel) fehlen jedoch.[22] L-Tryptophan ist in Deutschland zur Behandlung depressiver Erkrankungen nicht zugelassen. Als mildes Schlafmittel dürfen Tryptophan-haltige Arzneimittel ohne Rezept abgegeben werden (erhältlich als Tabletten mit 500 mg L-Tryptophan in variablen Packungsgrößen). Die Kennzeichnung der Packung muss vor der Einnahme durch Schwangere, Stillende sowie Kinder und Jugendliche warnen, auf die mögliche Beeinträchtigung der Fahrtüchtigkeit hinweisen und vor der Einnahme die Rücksprache mit einem Arzt oder Therapeuten nahelegen.[23] In Österreich ist L-Tryptophan rezeptpflichtig, in der Schweiz ist es als Nahrungsergänzungsmittel bis 240 mg Tageshöchstdosis[24] weder rezept- noch apothekenpflichtig.
Die stimmungsaufhellende Wirkung von L-Tryptophan beruht dabei vermutlich darauf, dass es im menschlichen Körper zu Serotonin umgewandelt wird. Es wird angenommen, dass durch einen erhöhten Serotoninspiegel die Stimmung aufgehellt und Depressionen gelindert werden können. Sollte Tryptophan zusätzlich in Form von Nahrungsergänzungsmitteln aufgenommen werden, auch zusammen mit Medikamenten, die den Serotoninspiegel weiter erhöhen, kann das sogenannte Serotoninsyndrom auftreten.[22] Als Nebenwirkungen sind hierbei zahlreiche Symptome wie z. B. Blutdruckanstieg (in schweren Fällen Koma und Schock), Hyperthermie, Schwitzen, Zittern, Myoklonie, Unruhe oder Durchfall bekannt.[25][22] Die Plasmahalbwertszeit beträgt 2 ± 0,1 Stunden; bei Lebererkrankungen wie Leberzirrhose kann diese auf 4,7 ± 0,4 h ansteigen.[26]
Zu einer Überdosierung von L-Tryptophan kommt es nur schwerlich, da L-Tryptophan selbst der Hauptaktivator seines abbauenden Enzyms Tryptophan-Pyrrolase (genauer: Tryptophan-2,3-Dioxygenase, EC 1.13.11.11) ist. Ein weiterer Aktivator ist Cortisol. Dies liefert auch eine Erklärung dafür, dass Stress (und der dadurch erhöhte Cortisolspiegel) zu einem verminderten Umsatz von L-Tryptophan zu 5-HTP führt. Nicotinsäure (Vitamin-B3) hingegen hemmt die Aktivität des Enzyms und fördert so den Umsatz von L-Tryptophan zu 5-HTP. Tryptophan-Pyrrolase baut L-Tryptophan unter Sauerstoffverbrauch zu N-Formyl-L-Kynurenin ab, welches in weitere Stoffe umgewandelt werden kann (u. a. Nicotinsäure). Dies ist auch der Hauptstoffwechselweg von L-Tryptophan (nur etwa 3 % wird zu 5-HTP bzw. Serotonin umgewandelt). Dabei fungiert Häm (Eisen) als Cofaktor. Einer Erhöhung der Zufuhr von L-Tryptophan steht ab einer gewissen Grenze eine überproportionale Aktivierung der Tryptophan-Pyrrolase gegenüber, so dass im Ergebnis mehr L-Tryptophan abgebaut wird, als zusätzlich zugeführt worden ist.[21]
Tryptophan-Skandal 1989[Bearbeiten | Quelltext bearbeiten]
L-Tryptophan war bis Januar 1996 in den Vereinigten Staaten verboten. Das Verbot geht zurück auf die Verwendung von vermutlich verunreinigtem L-Tryptophan des japanischen Unternehmens Shōwa Denkō in den 1980er Jahren. Diese Substanz enthielt u. a. ‚dimere‘ Tryptophan-Derivate, war gentechnisch hergestellt worden und soll für das Auftreten von EMS-Fällen (Eosinophilie-Myalgie-Syndrom) mit teilweise tödlichem Ausgang verantwortlich gewesen sein.[27] Die Entstehung des EMS ist nicht vollständig geklärt und dessen Wiederauftreten im Zusammenhang mit einer Einnahme von Tryptophan kann nicht ausgeschlossen werden. Schließlich konnten auch im Tierversuch Symptome des EMS mit Tryptophan-Derivaten und mit nicht verunreinigtem Tryptophan ausgelöst werden.[28]
Futtermittel[Bearbeiten | Quelltext bearbeiten]
Viele Getreidesorten weisen einen zu geringen Gehalt einer essentiellen Aminosäure auf. Durch diesen Mangel an nur einer Aminosäure sinkt die Verwertbarkeit aller aufgenommenen Aminosäuren auf den durch die in zu geringer Menge enthaltene essentielle Aminosäure („limitierende Aminosäure“)[29] bestimmten Wert; die biologische Wertigkeit ist reduziert. Der Nährwert des Getreides kann dann durch den gezielten Zusatz geringer Mengen jener essentieller Aminosäuren, die darin defizitär sind, gesteigert werden. Der Zusatz von L-Tryptophan zu Mischfuttern ist in der Futtermittel-Industrie verbreitet.[30]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Ardeydorm (D), Ardeytropin (D), Kalma (A, D), sowie ein Generikum (D)
AKE (D), Alvesin (D), Aminofusin (D), Aminomel (D, A), Aminomix (D, A), Aminopäd (D, A), Aminoplasmal (D, A), Aminosteril (D), Aminoven (D), Clinimix (D, A), Custodiol (D, A), Deltamin (D), Glamin (D), Glavcamin (A), Infesol (D), Intrafusin (D), Kabiven (D), Nephrotect (D), Nutriflex (D, A), OliClinomed (D, A), Pädamin (A), Parentamin (D), Periplasmal (D, A), Salviamin (D), SmofKabiven (A), StructoKabiven (D, A), Synthamin (D), Vamin (A), Vitromix (A)
Literatur[Bearbeiten | Quelltext bearbeiten]
- Berg/Tymoczko/Stryer: Biochemie, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3-8274-1303-6.
- Burger/Wachter: Hunnius Pharmazeutisches Wörterbuch Walter de Gruyter, 7. Auflage, Verlag 1993, ISBN 3-11-013868-9.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Unabhängige Pharmainformation über L-Tryptophan. bei der Medizinischen Universität Innsbruck, 1989
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt Tryptophan bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c Eintrag zu Tryptophan in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c d Eintrag zu L-Tryptophan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. Hirzel Verlag, Stuttgart 1991, ISBN 3-7776-0485-2, S. 823.
- ↑ a b c Eintrag zu Tryptophan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. November 2022. (JavaScript erforderlich)
- ↑ G. Curzon: HOPKINS AND THE DISCOVERY OF TRYPTOPHAN. In: Progress in Tryptophan and Serotonin Research 1986. De Gruyter, Berlin, Boston 1987, ISBN 978-3-11-085465-7, S. XXIX–XL, doi:10.1515/9783110854657-004 (degruyter.com [abgerufen am 19. Februar 2024]).
- ↑ IUPAC-IUB Commission on Biochemical Nomenclature A One-Letter Notation for Amino Acid Sequences. In: Journal of Biological Chemistry. 243. Jahrgang, Nr. 13, 10. Juli 1968, S. 3557–3559, doi:10.1016/S0021-9258(19)34176-6 (englisch, jbc.org [PDF]).
- ↑ a b Fritz Ullmann: Ullmann's encyclopedia of industrial chemistry. 5th ed Auflage. Band 2. VCH, Weinheim Deerfield beach (Fla.) 1985, ISBN 978-3-527-20102-0, S. 79.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Auflage.
- ↑ W. E. Savige, A. Fontana: Oxidation of tryptophan to oxindolylalanine by dimethyl sulfoxide-hydrochloric acid. Selective modification of tryptophan containing peptides. In: International journal of peptide and protein research. Band 15, Nummer 3, März 1980, S. 285–297, PMID 6155358.
- ↑ E. R. Radwanski, R. L. Last: Tryptophan biosynthesis and metabolism: biochemical and molecular genetics. In: Plant Cell, 1995, 7 (7), S. 921–934, PMID 7640526, plantcell.org (PDF).
- ↑ Charles Yanofsky: RNA-based regulation of genes of tryptophan synthesis and degradation, in bacteria. In: RNA. Band 13, Nr. 8, August 2007, S. 1141–1154, doi:10.1261/rna.620507, PMC 1924887 (freier Volltext).
- ↑ V. R. Young, A. E. El-Khoury: Human amino acid requirements: A re-evaluation. In: The United Nations University Press – Food and Nutrition Bulletin 17(3); Sept 1996 (Volltext).
- ↑ G. Lazaris-Brunner, M. Rafii, R. O. Ball, P. B. Pencharz: Tryptophan requirement in young adult women as determined by indicator amino acid oxidation with L-[13C]phenylalanine. In: Am. J. Clin. Nutr., 68(2), Aug 1998, S. 303–310, PMID 9701187.
- ↑ Steven B. Harris: 5-HTP: Doc Harris Presents Green Banana Award.
- ↑ S Comai, CV Costa, E Ragazzi, A Bertazzo, G Allegri: The effect of age on the enzyme activities of tryptophan metabolism along the kynurenine pathway in rats. In: Clin. Chim. Acta. 360. Jahrgang, Nr. 1–2, Oktober 2005, S. 67–80, doi:10.1016/j.cccn.2005.04.013, PMID 15970278 (englisch).
- ↑ B. Widner, A. Laich, B. Sperner-Unterweger, M. Ledochowski, D. Fuchs: Neopterin production, tryptophan degradation, and mental depression--what is the link? In: Brain Behav. Immunity. 16. Jahrgang, 2002, S. 590–595 (englisch).
- ↑ Fritz Ullmann: Ullmann's encyclopedia of industrial chemistry. 5th ed Auflage. Band 2. VCH, Weinheim Deerfield beach (Fla.) 1985, ISBN 978-3-527-20102-0, S. 66–67.
- ↑ Fritz Ullmann: Ullmann's encyclopedia of industrial chemistry. 5th ed Auflage. Band 2. VCH, Weinheim Deerfield beach (Fla.) 1985, ISBN 978-3-527-20102-0, S. 77, 83.
- ↑ M. Ledochowski, B. Widner, D. Fuchs: Fructose malabsorption and the decrease of serum tryptophan concentration. In: G. Huether, W. Kochen, T. J. Simat, H. Steinhart (Hrsg.): Tryptophan, serotonin, and melatonin: basic aspects and applications. Kluwer Academic / Plenum Publishers, New York 1999, S. 73–78.
- ↑ a b L-Tryptophan – nature’s answer to Prozac (Memento vom 16. März 2016 im Internet Archive) by James South MA.
- ↑ a b c Jana Meixner: Wirkung nicht belegt: Tryptophan gegen Depression. Medizin transparent, 25. Mai 2020, abgerufen am 7. Juli 2020.
- ↑ Bekanntmachung einer Allgemeinverfügung gemäß § 54 des Lebensmittel- und Futtermittelgesetzbuches (LFGB) für das Verbringen in die Bundesrepublik Deutschland und das Inverkehrbringen eines Nahrungsergänzungsmittels mit Zusatz von L-Tryptophan (BVL 14/01/004) vom 24. Februar 2014. Bundesamt für Verbraucherschutz und Lebensmittelsicherheit. Bundesanzeiger, 6. März 2014.
- ↑ Verordnung des EDI über Nahrungsergänzungsmittel, Teil B, Stand am 1. Juli 2020.
- ↑ Jan Niklas Herbel: Tryptophan - Anwendung, Wirkung, Nebenwirkungen. In: Gelbe Liste. 11. November 2021, abgerufen am 6. Juni 2022.
- ↑ M. Rössle, R. Herz, W. Hiss, W. Gerok: Der Tryptophan-Belastungstest als Funktionsparameter bei Lebererkrankungen., In: Klinische Wochenschrift, Band 61, Heft 6, März 1983, S. 277–283, doi:10.1007/BF01497776.
- ↑ Brian L. Williamson, Linda M. Benson, Andy J. Tomlinson, Arthur N. Mayeno, Gerald J. Gleich, Stephen Naylor: On-line HPLC-tandem mass spectrometry analysis of contaminants of l-tryptophan associated with the onset of the eosinophilia-myalgia syndrome. In: Toxicology Letters, 92, 1997, S. 139–148, doi:10.1016/S0378-4274(97)00048-9.
- ↑ Der Arzneimittelbrief, Jahrgang 2000, Ausgabe 3, S. 23.
- ↑ Yoshiharu Izumi, Ichiro Chibata, Tamio Itoh: Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie, 90, 1978, S. 187–194. Angewandte Chemie International Edition in English, 17, S. 176–183, doi:10.1002/anie.197801761.
- ↑ Manfred Kircher, Wolfgang Leuchtenberger: Aminosäuren – ein Beitrag zur Welternährung. In: Biologie in unserer Zeit, 28, 1998, S. 281–293.