2,4′-Bipyridin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4′-Bipyridin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H8N2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelb oranges kristallines Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 156,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2,4′-Bipyridin ist eine heterocyclische chemische Verbindung mit der Summenformel C10H8N2. Sie besteht aus zwei Pyridinringen, bei der die 2-Position des einen Rings mit der 4-Position des zweiten Rings verknüpft ist und gehört zur Gruppe der Bipyridine.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]2,4′-Bipyridin wurde in Tabak und Tabakrauch nachgewiesen.[3]
Darstellung
[Bearbeiten | Quelltext bearbeiten]2,4′-Bipyridin kann durch eine Negishi-Kupplung aus 2-Brompyridin und 4-Brompyridin hergestellt werden. Hierzu wird 2-Brompyridin zunächst mit n-Butyllithium lithiiert und unter Zugabe von Zinkchlorid zum Zinkorganyl transmetalliert. Als Katalysator zur Kupplung dient ein Palladiumkomplex mit Triphenylphosphanliganden.[4]
Des Weiteren fällt es in geringen Mengen als Nebenprodukt bei der Synthese anderer Bipyridine an, beispielsweise bei der Herstellung von 4,4′-Bipyridin aus Pyridin mit Lithiumdiisopropylamid und HMPT.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2,4′-Bipyridin ist bei Raumtemperatur ein weißer bis gelber Feststoff, der bei 64 °C schmilzt.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Reduktion kann 2,4′-Bipyridin zur Herstellung von 4-(2-Pyridyl)piperidin genutzt werden, das als Ausgangsstoff für weitere Synthese eingesetzt kann.[6] Hierzu wird zunächst das N-Oxid gebildet und anschließend an Palladium mit molekularem Wasserstoff reduziert.
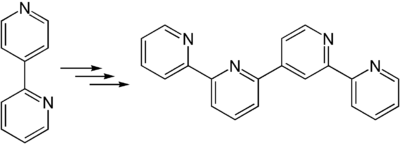
Auch zur Synthese von 2,2′:4′,2′′:6′′,2′′′-Quaterpyridin kann es verwendet werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu 2,4'-Bipyridyl, >97.0% bei TCI Europe, abgerufen am 16. Oktober 2023.
- ↑ a b c CRC Handbook of Chemistry and Physics, 85th Edition. Taylor & Francis, ISBN 978-0-8493-0485-9, S. 14-IA19 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alan Rodgman, Thomas A. Perfetti: The Chemical Components of Tobacco and Tobacco Smoke. CRC Press, 2016, ISBN 978-1-4665-1552-9, S. 1772 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. R. Sidler, N. Barta, W. Li, E. Hu, L. Matty, N. Ikemoto, J. S. Campbell, M. Chartrain, K. Gbewonyo, R. Boyd, E. G. Corley, R. G. Ball, R. D. Larsen, P. J. Reider, Paul J: Efficient synthesis of the optically active dihydropyrimidinone of a potent α1A-selective adrenoceptor antagonist. In: Canadian Journal of Chemistry. 80 (6), 2002, S. 646–652, doi:10.1139/v02-079.
- ↑ G. R. Newkome, D. C. Hager: Interconversion of cembranolide δ- and γ-lactones: synthesis of the C-1 epimer of isolobophytolide, in: J. Org. Chem., 1982, 47, S. 599–601 (doi:10.1021/jo00342a054).
- ↑ J.-C. Plaquevant, I. Chichaoui: Réduction régiospécifique des bipyridines, in: Tetrahedron Letters, 1993, 34, S. 5287–5288.
- ↑ J. A. Zoltewicz, M. P. Cruskie Jr., C. D. Dill: Use of pyridine N-oxide and pyridinium ion synthons in the preparation of oligopyridines. Two new unsymmetrical quaterpyridines with 2,2′-bipyridine units, in: Tetrahedron, 1996, 52, S. 4239–4244 (doi:10.1016/0040-4020(96)00100-7).