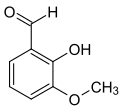
ortho-Vanillin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | ortho-Vanillin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H8O3 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe kristalline Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
265–266 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
ortho-Vanillin (2-Hydroxy-3-methoxybenzaldehyd) ist eine organische chemische Verbindung mit der Summenformel C8H8O3. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Methoxygruppe. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe in Bezug zur Aldehydgruppe.
Geschichte und Vorkommen
[Bearbeiten | Quelltext bearbeiten]ortho-Vanillin wurde erstmals 1876 durch Ferdinand Tiemann entdeckt.[4] Es kommt in Extrakten und ätherischen Ölen vieler Pflanzen vor.[5][6][7] Im Jahr 1910 entwickelte Francis Nölting Methoden für die Reindarstellung, ferner konnte er die Vielseitigkeit dieser Verbindung als Synthesevorstufe für eine große Reihe von Verbindungen, wie die Cumarine, aufzeigen.[8] Im Jahr 1920 wurde die Verbindung zum Färben tierischer Häute verwendet.[9] In Lebensmitteln ist es jedoch nicht besonders gefragt und ist daher ein weniger oft produzierter und anzutreffender Zusatzstoff.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]ortho-Vanillin bildet hellgelbe kristalline Nadeln.[1] Es schmilzt bei 43–45 °C[2] und siedet bei 265–266 °C.[2] Es ist löslich in THF, Ethanol und Methanol.[3] Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Fdd2 (Raumgruppen-Nr. 43) mit den Gitterparametern a = 2509,9 pm, b = 2452,2 pm, c = 479,1 pm und 16 Formeleinheiten pro Elementarzelle.[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Es unterscheidet sich deutlich von seinem Isomer, dem Vanillin, denn im Gegensatz dazu besitzt es nicht den charakteristischen und intensiven Geruch von Vanille. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe in Bezug zur Aldehydgruppe; im Vanillin befinden sich diese beiden Gruppen in para-Stellung.
ortho-Vanillin kann durch Schmelzen mit Kaliumhydroxid in ortho-Vanillinsäure umgewandelt werden. Diese wiederum kann mit Bromwasserstoff 2,3-Dihydroxybenzoesäure bilden.[10]
Biologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]ortho-Vanillin ist ein schwacher Inhibitor der Tyrosinase,[11] und zeigt sowohl antimutagene als auch comutagene Eigenschaften in Escherichia coli.[12][13] Es besitzt moderate antimykotische und antibakterielle Eigenschaften.[14]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c F. Iwasaki, I. Tanaka, A. Aihara: „2-Hydroxy-3-methoxybenzaldehyde (o-Vanillin)“, in: Acta Cryst. B, 1976, 32 (4), S. 1264–1266; doi:10.1107/S0567740876005086.
- ↑ a b c d e f g Datenblatt o-Vanillin bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- ↑ a b Solubility of ortho-vanillin in non-aqueous solvents
- ↑ Ferdinand Tiemann: „Ueber die der Coniferyl- und Vanillinreihe angehörigen Verbindungen“, in: Berichte der Deutschen Chemischen Gesellschaft, 1876, 9, S. 409–423; doi:10.1002/cber.187600901133 (Digitalisat auf Gallica).
- ↑ A. H. Abou Zeid, A. A. Sleem: „Natural and stress constituents from Spinacia oleracea L. leaves and their biological activities“, in: Bulletin of the Faculty of Pharmacy (Cairo University), 2002, 40 (2), S. 153–167.
- ↑ Jean-Christophe Barbe, Alain Bertrand: „Quantitative analysis of volatile compounds stemming from oak wood. Application to the aging of wines in barrels“, in: Journal des Sciences et Techniques de la Tonnellerie, 1996, 2, S. 77–88.
- ↑ E. J. Brunke, F. J. Hammerschmidt, G. Schmaus: „Das etherische Öl von Santolina chamaecyparissus L. (Santolina chamaecyparissus essential oil)“, in: Parfümerie und Kosmetik, 1992, 73 (9), S. 617–618, 623–624, 626, 628–630, 632, 634–637.
- ↑ Francis A. M. Noelting: „o-Hydroxy-m-methoxybenzaldehyde (Orthovanillin)“, in: Annales de Chimie et de Physique, 1910, 19, S. 476–550.
- ↑ Otto Gerngross: „Die Färbungen tierischer Haut durch o-Vanillin und o-Protocatechualdehyd und die Aldehydgerbung“, in: Angewandte Chemie, 1920, 33 (44), S. 136–138; doi:10.1002/ange.19200334403.
- ↑ V. K. Ahluwalia: Intermediates For Organic Synthesis. I. K. International Pvt Ltd, 2005, ISBN 978-81-88237-33-3, S. 76 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Isao Kubo, Ikuyo Kinst-Hori: „Tyrosinase inhibitory activity of the olive oil flavor compounds“, in: Journal of Agricultural and Food Chemistry, 1999, 47 (11), S. 4574–4578; doi:10.1021/jf990165v.
- ↑ Kazuko Watanabe, Toshihiro Ohta, Yasuhiko Shirasu: „Enhancement and inhibition of mutation by o-vanillin in Escherichia coli“, in: Mutation Research, 1989, 218 (2), S. 105–109; PMID 2671704.
- ↑ Kazuhiko Takahashi, Mutsuo Sekiguchi, Yutaka Kawazoe: „A specific inhibition of induction of adaptive response by o-vanillin, a potent comutagen“, in: Biochemical and Biophysical Research Communications, 1989, 162 (3), S. 1376–1381; PMID 2669748.
- ↑ I. Leifertova, N. Hejtmankova, H. Hlava, J. Kudrnacova, F. Santavy: „Antifungal and antibacterial effects of phenolic substances. A study of the relation between the biological activity and the constitution of the investigated compounds“, in: Acta Universitatis Palackianae Olomucensis, Facultatis Medicae, 1975, 74, S. 83–101.