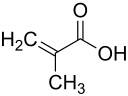
Methacrylsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methacrylsäure | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H6O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
161 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (98 g·l−1 (20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4314 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Methacrylsäure ist eine ungesättigte Carbonsäure, eine sogenannte Alkensäure, und wird als Ausgangsstoff zur Herstellung von Kunststoffen verwendet. Die Salze und Ester der Methacrylsäure werden als Methacrylate bezeichnet.
Geschichte und Vorkommen
[Bearbeiten | Quelltext bearbeiten]Methacrylsäure wurde von Edward Frankland und Baldwin Francis Duppa zuerst in Form ihres Ethylesters durch Reaktion von Phosphorpentachlorid mit einem Ester der Isobuttersäure erhalten.[6] Die polymere Form der Methacrylsäure wurde im Jahre 1880 zuerst beschrieben.[7] Sie kommt als Ester natürlich in Kamillenöl vor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Mehr als 3 Millionen Tonnen Methacrylsäure werden jährlich produziert, wobei ein erheblicher Teil von Synthesen anderer chemischer Verbindungen ebenfalls über die Zwischenstufe Methacrylsäure gehen. Industriell wird sie aus Isobutylen und tert-Butanol hergestellt, welche erst zu Methacrolein und dieses dann weiter zu Methylmethacrylat oxidiert werden.[8] Synthetisch kann sie ebenfalls durch Hydrolyse von Acetoncyanhydrin und anschließende Wasserabspaltung hergestellt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methacrylsäure ist eine farblose Flüssigkeit mit unangenehmem Geruch. Die Dämpfe der Methacrylsäure sind schwerer als Luft. Feste Methacrylsäure bildet prismatische Kristalle. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 8,1, B = 2621 und C = −4,2 im Temperaturbereich von 298 bis 434 K.[9] Sie löst sich in Wasser, Alkohol und Ether; die wässrige Lösung reagiert stark sauer.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methacrylsäure polymerisiert sehr leicht beim Erwärmen, unter Einwirkung von Licht oder in Gegenwart von Salzsäure bzw. Peroxiden unter Bildung hochpolymerer Produkte. Durch Zusatz von Stabilisatoren wie Hydrochinon oder Hydrochinonmonomethylether kann Methacrylsäure dennoch längere Zeit in monomerer Form aufbewahrt werden. Die Polymerisationswärme beträgt −64,5 kJ·mol−1 bzw. −749 kJ·kg−1.[10]
Bei der Neutralisation der wässrigen Lösungen mit Metalloxiden, -hydroxiden oder -alkoholaten werden die entsprechenden Metall-Acrylate in Lösung erhalten. Zur Gewinnung der kristallinen Salze, kann die Neutralisation beispielsweise in iso-Propanol durchgeführt werden, in dem zwar die freie Säure löslich ist, ihre Salze jedoch nicht.[11]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Methacrylsäure bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Mit einem Flammpunkt von 68 °C gilt die Substanz als schwer entflammbar.[2] Der Explosionsbereich liegt zwischen 2,1 Vol.‑% als untere Explosionsgrenze (UEG) und 8,7 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Zündtemperatur beträgt 385 °C.[2][9] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bei der Herstellung von Kunststoffdispersionen durch die Emulsionspolymerisation wird häufig ein geringer Anteil Methacrylsäure u. a. zur Erhöhung der kollidalen Stabilität copolymerisiert. Im Gegensatz zur Acrylsäure wird die Methacrylsäure dabei gleichmäßiger in die Teilchen eingebaut. Wässrige (neutralisierte) Lösungen polymerer Methacrylsäure oder methacrylsäurehaltiger Copolymere finden Verwendung als Netzmittel oder Verdicker z. B. bei der Herstellung von Dispersionsfarben. Es dient jedoch auch zur Herstellung anderer Monomere (z. B. Hydroxyethylmethacrylat, kurz HEMA).
Die Ester der Methacrylsäure (Veresterung mit Butyl- oder längerkettigen Alkoholen) werden zur Herstellung von Kunststoffen verwendet. Wichtige Polymethacrylate (oder Polymethacrylsäureester) sind:
- Polymethacrylsäuremethylester, Polymethylmethacrylat, kurz PMMA, Plexiglas aus Methacrylsäuremethylester, dem Methylester der Methacrylsäure
- Polymethacrylsäureethylester, kurz PEMA
- Polymethacrylsäurepropylester, kurz PPMA
- Polymethacrylsäurebutylester, kurz PBMA
- Polymethacrylsäureisopropylester
- Eudragit: Die verschiedenen Varianten von Eudragit sind anionische Copolymere von Methacrylsäure und Methylmethacrylat. Sie sind in Magensaft und in reinem Wasser unlöslich. In neutralen bis alkalischen Medien lösen sie sich durch Salzbildung mit Alkali auf und liefern magensaftresistente und darmsaftlösliche Überzüge. Auf diese Weise kann man Medikamente gut geschützt durch den Magen transportieren.[12]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]
Methacrylsäure kann in einem Thermischen Durchgehen spontan sehr heftig, je nach Bedingungen explosionsartig und unter Zersetzung polymerisieren (siehe auch Trommsdorff-Effekt). Käufliche Methacrylsäure ist daher immer mit einem Polymerisationsinhibitor versetzt. Bei der Lagerung ist darauf zu achten, dass die Säure nicht einfriert (Erstarrungstemperatur 15 °C). Beim Einfrieren verarmt die kristallisierte Methacrylsäure an Inhibitor und Sauerstoff, da diese zum Teil ausfallen, so dass auch nach dem Auftauen noch ein starkes Konzentrationsgefälle des Inhibitors innerhalb des Lagerbehälters auftreten kann. Eingefrorene Methacrylsäure muss daher vorsichtig (Temperaturen über 50 °C sind zu vermeiden), langsam und unter ständiger Durchmischung aufgetaut werden. Dies sollte nur durch sachkundige Personen durchgeführt werden (die Hersteller stellen dazu im Sicherheitsdatenblatt eine Beratungsmöglichkeit, häufig auch eine Notfallhotline zur Verfügung). Ist diese nicht zur Stelle, so kann die kristallisierte Acryl- oder Methacrylsäure unterhalb des Schmelzpunktes, jedoch unter 0 °C gelagert werden. In diesem Zustand ist Methacrylsäure unkritisch. Keinesfalls darf aus teilweise eingefrorenen Behältern flüssige Säure entnommen werden, da dadurch ein Großteil des Inhibitors mit entnommen wird und so beim Wiederaufschmelzen des eingefrorenen Teils der Methacrylsäure nicht mehr zur Verfügung steht.
Nachweis und Analyse
[Bearbeiten | Quelltext bearbeiten]Die Säurezahl kann klassisch volumetrisch mit Natronlauge gegen Phenolphthalein sowie der Wassergehalt nach Karl-Fischer bestimmt werden.
Zur Bestimmung des Gehaltes an Doppelbindungen kann die Pyridinsulfatbibromidmethode angewendet werden, die auf einer Bromierung der Doppelbindung und anschließender Titration mit Natriumthiosulfat beruht.
Neben den nasschemischen Methoden können auch klassische physikalische Methoden für die Analyse herangezogen werden[11]:
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu METHACRYLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Methacrylsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-326.
- ↑ Eintrag zu Methacrylic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 79-41-4 bzw. Methacrylsäure), abgerufen am 2. November 2015.
- ↑ E. Frankland, B. F. Duppa: Untersuchungen über Säuren aus der Acrylsäure-Reihe; 1) Umwandlung der Säuren aus der Milchsäure-Reihe in die der Acrylsäure-Reihe. In: Annalen der Chemie und Pharmacie. Band 136, Nr. 1, 1865, S. 1–31, doi:10.1002/jlac.18651360102 (Hier: S. 12).
- ↑ Rudolph Fittig, F. Engelhorn: II. Untersuchungen über die ungesättigten Säuren. In: Justus Liebigs Annalen der Chemie. Band 200, Nr. 1-2, 1880, S. 21–96, doi:10.1002/jlac.18802000103 (Hier: S. 65 ff.).
- ↑ William Bauer, Jr. Methacrylic Acid and Derivatives in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_441.
- ↑ a b E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ Brandrup, J.; Immergut, E.H.; Grulke, E.A.; Abe, A.; Bloch, D.R.: Polymer Handbook, 4th Edition, Wiley-VCH 2003, ISBN 978-0-471-47936-9, S. II/369.
- ↑ a b Rauch Puntigam, Theodor Volker: Acryl- und Methacrylverbindungen. In: Chemie, Physik und Technologie der Kunststoffe in Einzeldarstellungen. Band 9. Springer, Berlin, Heidelberg, New York 1967, ISBN 978-3-642-46058-6.
- ↑ Evonik: EUDRAGIT® L 30 D-55

