Ethylvanillin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylvanillin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H10O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Schuppen mit süß-cremigem, blumigem Geruch[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 166,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
kaum löslich in Wasser, löslich in Ethanol und Ether[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ethylvanillin (3-Ethoxy-4-hydroxybenzaldehyd, Bourbonal, FEMA 2464[1]) ist eine organische chemische Verbindung mit der Summenformel C9H10O3. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Ethoxygruppe. Es unterscheidet sich vom Vanillin, indem man die Methylgruppe gegen eine Ethylgruppe austauscht. Es kommt nicht natürlich vor.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Eine gängige Möglichkeit ist die Substitutionsreaktion von o-Ethoxyphenol (1) mit Glyoxylsäure und anschließende Oxidation der gebildeten Säure (2) zu 4-Hydroxy-3-ethoxyphenylglyoxylsäure (3), die zu Ethylvanillin (4) decarboxyliert wird.

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ethylvanillin tritt in Form farbloser Schuppen mit süß-cremigem, blumigem Geruch auf und schmilzt bei 77–78 °C.[3] Es ist kaum löslich in Wasser, jedoch löslich in Ethanol und Ether.[3] Vanillin und Ethylvanillin besitzen zudem einen ähnlichen Geruch, das Ethylvanillin ist 2- bis 4-mal intensiver.[3][5] Vanillin und Ethylvanillin lassen sich mit Gemischen aus n-Hexan und Essigsäureethylester per Dünnschichtchromatographie gut trennen.[6] Mit konz. Schwefelsäure färbt es sich gelb, im Gegensatz zu Vanillin.[7]
Isomere und strukturelle Verwandte
[Bearbeiten | Quelltext bearbeiten]Isoethylvanillin (3-Hydroxy-4-ethoxybenzaldehyd) ist ein Isomer und unterscheidet sich vom Ethylvanillin durch die Stellung der Ethoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Ethoxygruppe tauschen im Vergleich zum Ethylvanillin die Plätze. Die Strukturanalogie entspricht der zwischen Vanillin und Isovanillin.
ortho-Ethylvanillin (Novovanillin, 2-Hydroxy-3-ethoxybenzaldehyd) ist gleichfalls ein Isomer und unterscheidet sich vom Ethylvanillin durch die Stellung der Hydroxygruppe. Die Vorsilbe ortho- kennzeichnet hier die Position der Hydroxygruppe in Bezug zur Aldehydgruppe; im Ethylvanillin befinden sich diese beiden Gruppen in para-Stellung. Die Strukturanalogie entspricht der zwischen Vanillin und ortho-Vanillin.
 |
 |

|
| Isoethylvanillin | Ethylvanillin | ortho-Ethylvanillin (Novovanillin) |
Verwendung
[Bearbeiten | Quelltext bearbeiten]Heute wird Ethylvanillin als künstlicher Aromastoff anstelle des Vanillins verwendet.[8] Als Aromazusatz ist es vor allem in Speiseeis, Brausen, Süß- und Backwaren verbreitet.[3] Laut Verordnung (EG) Nr. 1334/2008 darf es ohne Höchstmengenbeschränkung in Lebensmitteln verwendet werden.[9]
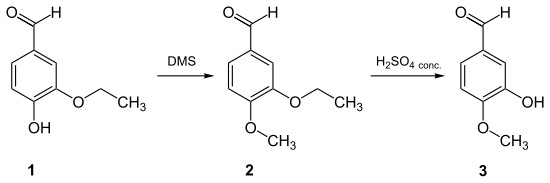
Zur Synthese von Isovanillin eignet sich u. a. Ethylvanillin (1), welches mit Dimethylsulfat zum 3-Ethoxy-4-methoxybenzaldehyd (2) methyliert wird. Anschließend wird mit Schwefelsäure selektiv der Ethylether gespalten.[10]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Beilstein E IV 8, 1765.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Ethylvanillin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 14. Dezember 2012.
- chemgapedia (Duftstoffe: Vanillin/Ethylvanillin als Beispiel): Teil 1, Teil 2.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu FEMA 2464 in der Datenbank der Flavor and Extract Manufacturers Association of the United States.
- ↑ Eintrag zu ETHYL VANILLIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 14. Juli 2020.
- ↑ a b c d e f g Eintrag zu Ethylvanillin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ a b c Datenblatt Ethyl vanillin bei Sigma-Aldrich, abgerufen am 31. März 2011 (PDF).
- ↑ Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi: Structural determination of vanillin, isovanillin and ethylvanillin by means of gas electron diffraction and theoretical calculations. In: Journal of Molecular Structure. 2006, 794 (1–3), S. 92–102; doi:10.1016/j.molstruc.2006.01.042; PDF.
- ↑ A. V. Gerasimov, N. V. Gornova, N. V. Rudometova: Determination of Vanillin and Ethylvanillin in Vanilla Flavorings by Planar (Thin-Layer) Chromatography. In: Journal of Analytical Chemistry. 2003, 58 (7), S. 677–684; doi:10.1023/A:1024764205281.
- ↑ George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. Sixth Edition, CRC Press, 2010, ISBN 978-1-4200-9077-2, S. 674.
- ↑ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, ISBN 978-3-527-30385-4, (doi:10.1002/14356007.a11_141).
- ↑ Verordnung (EG) Nr. 1334/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Aromen und bestimmte Lebensmittelzutaten mit Aromaeigenschaften zur Verwendung in und auf Lebensmitteln sowie zur Änderung der Verordnung (EWG) Nr. 1601/91 des Rates, der Verordnungen (EG) Nr. 2232/96 und (EG) Nr. 110/2008 und der Richtlinie 2000/13/EG
- ↑ Patent DE69507676T2: Verfahren zur Herstellung von Isovanillin. Angemeldet am 20. Oktober 1995, veröffentlicht am 29. Juli 1999, Anmelder: Rhone Poulenc Chimie, Erfinder: Christian Maliverney.
