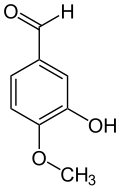
Isovanillin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isovanillin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H8O3 | ||||||||||||||||||
| Kurzbeschreibung |
schwach gelbliche glasglänzende Säulen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
8,89 (25 °C)[3] | ||||||||||||||||||
| Löslichkeit |
in heißem Wasser leicht, in kaltem kaum löslich; sehr leicht löslich in Chloroform, leicht in Ethanol, Ether, Methanol und Eisessig[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Isovanillin (3-Hydroxy-4-methoxybenzaldehyd) ist eine organische chemische Verbindung mit der Summenformel C8H8O3. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Methoxygruppe. Isovanillin ist ein nahezu geruchloses Isomer zum Vanillin, von dem es sich nur durch die Stellung der Methoxygruppe unterscheidet. Es dient als Synthesebaustein und findet vor allem im Pharma-, Kosmetik-, Agrar- und Nahrungsmittelbereich Verwendung.
Geschichte und Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Isovanillin wurde 1882 von Rudolf Wegscheider isoliert und charakterisiert.[1] Es kommt u. a. in Mondia whitei[4][5] und Maniok[6] vor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natürliche Quellen
[Bearbeiten | Quelltext bearbeiten]Die Isolierung von Isovanillin geschieht entweder durch Extraktion mit verschiedenen Lösungsmitteln aber auch durch Wasserdampfdestillation aus getrockneten Wurzeln der Mondia whitei.[4][5][7]
Technische Synthesen
[Bearbeiten | Quelltext bearbeiten]Zur Darstellung sind zahlreiche Verfahren bekannt:[8]
- Piperonal (3,4-(Methylendioxy)-benzaldehyd) wird mit Natriummethanolat in Gegenwart von Kupfer(I)-chlorid in Dimethylformamid umgesetzt.[9]
- Veratrumaldehyd (3,4-Dimethoxybenzaldehyd) kann durch selektive Demethylierung mit Methionin in Methansulfonsäure zu Isovanillin umgesetzt werden.[10] Die Reaktionszeiten sind lang und die Selektivität ist nicht sehr hoch.
- Eine selektive O-Methylierung von Protocatechualdehyd (3,4-Dihydroxybenzaldehyd) durch Methyliodid in Gegenwart von Natriumhydrid in Dimethylsulfoxid führt zu einer Ausbeute von etwa 65 % Isovanillin.[11]
- Eine Formylierung von Guajacol (o-Methoxyphenol), welches als Acetat geschützt ist, erfolgt mit Dichlormethoxymethan in Gegenwart von Titantetrachlorid in Dichlormethan. Der 3-Acetoxy-4-methoxybenzaldehyd wird anschließend mit NaOH hydrolysiert.[12]
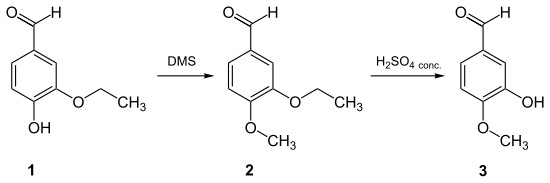
- Isovanillin lässt sich in guter Ausbeute erhalten, indem man bei einem 3-Alkoxy-4-methoxybenzaldehyd mittels einer starken Säure selektiv in 3-Stellung die Alkylgruppe abspaltet, wobei die Alkoxygruppe mindestens zwei Kohlenstoffatome enthält. Hierzu eignet sich u. a. Ethylvanillin (1), welches mit Dimethylsulfat zum 3-Ethoxy-4-methoxybenzaldehyd (2) methyliert wird. Anschließend wird mit Schwefelsäure selektiv der Ethylether gespalten.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Isovanillin bildet schwach gelbliche glasglänzende Säulen[1], schmilzt bei 113–115 °C[2] und siedet bei 179 °C bei Unterdruck (15 mmHg; ≈ 20 hPa)[2]. Es ist in heißem Wasser leicht, in kaltem kaum löslich; hingegen ist es leicht löslich in Chloroform, Ethanol, Ether, Methanol und Eisessig.[1] Es kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 851,7 pm, b = 1338,0 pm, c = 639,0 pm, β = 97,21° und vier Formeleinheiten pro Elementarzelle.[13]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Isovanillin leitet sich strukturell sowohl vom Benzaldehyd als auch vom Guajacol (2-Methoxyphenol) ab. Es unterscheidet sich als Isomer vom Vanillin durch die Stellung der Methoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Vanillin die Plätze. Im Gegensatz zum Vanillin ist es nahezu geruchlos.[14][15]
Es bildet mit einer wässrigen Lösung von Eisen(III)-chlorid jedoch keine Färbung.[1] Der pKs-Wert der phenolischen OH-Gruppe beträgt 8,89 (25 °C).[3] Dieser Wert ist gegenüber dem Phenol mit 9,99[3] niedriger; die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert.
Biologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Isovanillin ist ein selektiver Inhibitor der Aldehydoxidase. Es ist kein Substrat dieses Enzyms und wird von der Aldehyddehydrogenase zu Isovanillinsäure metabolisiert.[16][17][18][19][20]
Strukturelle Verwandte
[Bearbeiten | Quelltext bearbeiten]Isovanillylalkohol (3-Hydroxy-4-methoxybenzylalkohol) entsteht durch Reduktion von Isovanillin. Isovanillinsäure (3-Hydroxy-4-methoxybenzoesäure) entsteht durch Oxidation, z. B. auf enzymatischen Weg.[20]
Isoethylvanillin (3-Hydroxy-4-ethoxybenzaldehyd) ist ein struktureller Verwandter und unterscheidet sich vom Isovanillin, indem man die Methylgruppe gegen eine Ethylgruppe austauscht. Die Strukturanalogie entspricht der zwischen Vanillin und Ethylvanillin.
iso-Acetovanillon (3-Hydroxy-4-methoxyacetophenon) ist gleichfalls ein struktureller Verwandter und unterscheidet sich vom Isovanillin, indem man die Formylgruppe (Aldehydgruppe) gegen eine Acetylgruppe austauscht. Die Strukturanalogie entspricht der zwischen Vanillin und Acetovanillon.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Isovanillin dient als Synthesebaustein vor allem im Pharma-, Kosmetik-, Agrar- und Nahrungsmittelbereich.[8][21][22][23]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Rudolf Wegscheider: "Über Isovanillin", in: Monatshefte für Chemie, 1882, 3 (1), S. 789–795 (doi:10.1007/BF01516846).
- ↑ a b c d e f Datenblatt 3-Hydroxy-4-methoxybenzaldehyde bei Sigma-Aldrich, abgerufen am 31. Januar 2013 (PDF).
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6, S. 434, Nr. 54.
- ↑ a b Neil A. Koorbanally, Dulcie A. Mulholland, Neil R. Crouch: "Isolation of Isovanillin from Aromatic Roots of the Medicinal African Liane, Mondia whitei", in: Journal of Herbs, Spices & Medicinal Plants, 2000, 7 (3), S. 37–43 (doi:10.1300/J044v07n03_05).
- ↑ a b Kavaka W. Mukonyi, Isaiah O. Ndiege: "2-Hydroxy-4-methoxybenzaldehyde: Aromatic Taste Modifying Compound from Mondia whytei Skeels", in: Bull. Chem. Soc. Ethiop., 2001, 15 (2), S. 137–141 (PDF).
- ↑ Bo Yi, Lifei Hu, Wenli Mei, Kaibing Zhou, Hui Wang, Ying Luo, Xiaoyi Wei, Haofu Dai: "Antioxidant Phenolic Compounds of Cassava (Manihot esculenta) from Hainan", in: Molecules, 2010, 16, S. 10157–10167 (doi:10.3390/molecules161210157; PDF).
- ↑ Patentanmeldung DE102009046126A1: Oral konsumierbare Zubereitung umfassend Wurzelextrakt aus Mondia whitei. Angemeldet am 28. Oktober 2009, veröffentlicht am 12. Mai 2011, Anmelder: Symrise AG, Erfinder: Jakob Peter Ley et al.
- ↑ a b c Patent DE69507676T2: Verfahren zur Herstellung von Isovanillin. Angemeldet am 20. Oktober 1995, veröffentlicht am 29. Juli 1999, Anmelder: Rhone Poulenc Chimie, Erfinder: Christian Maliverney.
- ↑ N. Yu. Baratov, V. I. Vinogradova, M. S. Yunusov (Inst. Khim. Rastit. Veshchestv, Tashkent, USSR): "Reaction of 3,4-methylenedioxybenzaldehydes with sodium methoxide", in: Zh. Org. Khim., 1991, 27 (7), S. 1578–1579.
- ↑ Nobutaka Fujii, Hiroshi Irie, Haruaki Yajima: "Regioselective Cleavage of Aromatic Methyl Ethers by Methanesulphonic Acid in the Presence of Methionine", in: J. Chem. Soc., Perkin Trans. 1, 1977, 20, S. 2288–2288 (doi:10.1039/P19770002288).
- ↑ Satinder V. Kessar, Yash P. Gupta, Taj Mohammed, (Miss) Manju Goyal, Kewal K. Sawal: "Regioselective Mono-O-alkylation of some Pyrocatechoxide Dianions", in: J. Chem. Soc., Chem. Commun., 1983, 7, S. 400–401 (doi:10.1039/C39830000400).
- ↑ Maria Luisa Scarpati, Armandodoriano Bianco, Livia Mascitelli, Pietro Passacantilli: "Selective Formylation of Diphenols", in: Synth. Commun., 1990, 20 (17), S. 2565–2572 (doi:10.1080/00397919008051462).
- ↑ Fujiko Iwasaki: "The Crystal Structure of 3-Hydroxy-4-methoxybenzaldehyde (Isovanillin)", in: Chemistry Letters, 1973, 2 (3), S. 227–228 (doi:10.1246/cl.1973.227; PDF).
- ↑ Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi: "Structural determination of vanillin, isovanillin and ethylvanillin by means of gas electron diffraction and theoretical calculations", in: Journal of Molecular Structure, 2006, 794 (1–3), S. 92–102 (doi:10.1016/j.molstruc.2006.01.042; PDF).
- ↑ Riechstofflexikon: Vanillin.
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: Enzymatic oxidation of phthalazine with guinea pig liver aldehyde oxidase and liver slices: inhibition by isovanillin. In: Acta Biochimica Polonica, 2004, 51 (4), S. 943–951 (PMID 15625566; PDF).
- ↑ Georgios I. Panoutsopoulos, Demetrios Kouretas, Christine Beedham: Contribution of Aldehyde Oxidase, Xanthine Oxidase, and Aldehyde Dehydrogenase on the Oxidation of Aromatic Aldehydes. In: Chemical Research in Toxicology, 2004, 17 (10), S. 1368–1376 (doi:10.1021/tx030059u; PMID 15487898).
- ↑ Georgios I. Panoutsopoulos: Phenylacetaldehyde oxidation by freshly prepared and cryopreserved guinea pig liver slices: the role of aldehyde oxidase. In: International Journal of Toxicology, 2005, 24 (2), S. 103–109 (doi:10.1080/10915810590936373; PMID 16036769).
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: Metabolism of isovanillin by aldehyde oxidase, xanthine oxidase, aldehyde dehydrogenase and liver slices. In: Pharmacology, 2005, 73 (4), S. 199–208 (doi:10.1159/000082860; PMID 15627845).
- ↑ a b Georgios I. Panoutsopoulos, Christine Beedham: "Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices", in: Cell Physiol Biochem, 2005, 15 (1–4), S. 89–98 (PMID 15665519; PDF).
- ↑ Keng-Shiang Huang, Eng-Chi Wang: "Synthesis of Substituted Indenes from Isovanillin via Claisen Rearrangement and Ring-closing Metathesis", in: Journal of the Chinese Chemical Society, 2004, 51, S. 383–391 (doi:10.1002/jccs.200400060).
- ↑ Sie-Rong Li, Chung-Jung Shu, Liang-Yeu Chen, Hsing-Ming Chen, Po-Yuan Chen, Eng-Chi Wang: "Synthesis of substituted 2-aroyl-3-methylchromen-4-ones from isovanillin via 2-aroyl-3-methylchroman intermediates", in: Tetrahedron, 2009, 65 (42), S. 8702–8707 (doi:10.1016/j.tet.2009.08.043).
- ↑ Roger M. Davey, N. Patrick J. Stamford: "Catalytic enamines from dialkylamide-dialkylacetals", in: Tetrahedron Letters, 2012, 53 (20), S. 2537–2539 (doi:10.1016/j.tetlet.2012.03.028).
Literatur
[Bearbeiten | Quelltext bearbeiten]- R. H. Prager, Y. T. Tan: "Selective demethylation of 3,4-dimethoxybenzaldehyde", in: Tetrahedron Letters, 1967, 8 (38), S. 3661–3664 (doi:10.1016/S0040-4039(01)89768-9).
- V. Balachandran, K. Parimala: "Vanillin and isovanillin: Comparative vibrational spectroscopic studies, conformational stability and NLO properties by density functional theory calculations", in: Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2012, 95, S. 354–368 (doi:10.1016/j.saa.2012.03.087; PMID 22542395).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Isovanillin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 1. November 2012.
- NMRanalyst Sample Application: Isovanillin.