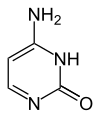
Cytosin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cytosin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H5N3O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Plättchen[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 111,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
in siedendem Wasser und Ethanol mäßig, unlöslich in Diethylether[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−221,3 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Cytosin (C, Cyt) ist eine der vier Nukleinbasen in der DNA und RNA, zusammen mit Adenin, Guanin und Thymin (Uracil in RNA). Es ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst und zwei Substituenten (Aminogruppe an Position 4 und Sauerstoffatom an Position 2). Das Nukleosid von Cytosin ist das Desoxycytidin in der DNA und das Cytidin in der RNA. In der Watson-Crick-Basenpaarung bildet es drei Wasserstoffbrücken mit Guanin.
Geschichte, Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Das Cytosin wurde zuerst im Jahr 1894 von dem späteren Nobelpreisträger Albrecht Kossel und seinem Assistenten Albert Neumann aus der Thymusdrüse von Kälbern gewonnen.[6][7]
1903 wurde die chemische Struktur durch Albrecht Kossel in Zusammenarbeit mit Hermann Steudel aufgeklärt[8][9] und die erste erfolgreiche Synthese durchgeführt[10].
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cytosin bildet farblose Plättchen mit einem Schmelzpunkt von über 300 °C. Es löst sich in siedendem Wasser und Ethanol mäßig, es ist unlöslich in Diethylether.
Cytosin ist tautomer, wobei die 1H-Form überwiegt.[11]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cytosin besitzt aufgrund des planar gebauten Rings mit sechs delokalisierten π-Elektronen aromatische Eigenschaften.
Die Verbindung kann relativ leicht, zum Uracil desaminieren.[12]
Biologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Cytosin kann Bestandteil der DNA, RNA oder verschiedener Nukleoside und Nukleotide sein.
Nukleoside
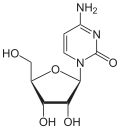
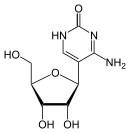
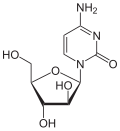
[Bearbeiten | Quelltext bearbeiten]Über das N1-Atom des Ringes kann Cytosin an das C1-Atom der Ribose N-glycosidisch gebunden werden; man spricht dann von einem Nukleosid, dem Cytidin. Bei der Bindung an Desoxyribose entsteht das Nukleosid Desoxycytidin. Wird Cytosin jedoch über das C5-Atom des Ringes an das C1-Atom der Ribose C-glycosidisch gebunden, dann entsteht das synthetische Pseudocytidin. Das Cytarabin enthält – im Gegensatz zu den meisten Nukleosiden – anstelle der Ribose die Arabinose.
Nukleotide
[Bearbeiten | Quelltext bearbeiten]Über die Phosphorylierung des Cytidins am C5-Atom der Ribose gelangt man zu den wichtigen Nukleotiden Cytidinmonophosphat (CMP), Cytidindiphosphat (CDP) und Cytidintriphosphat (CTP), oder analog für das Desoxycytidin zu Desoxycytidinmonophosphat (dCMP), Desoxycytidindiphosphat (dCDP) und Desoxycytidintriphosphat (dCTP).
Als Cytidintriphosphat (CTP) dient es als Kofaktor für diverse Enzyme und kann seine Phosphatgruppe an ADP zum Aufbau von ATP abgeben.
Bestandteil der DNA und RNA
[Bearbeiten | Quelltext bearbeiten]In der DNA-Doppelhelix bildet Cytosin über die Oxogruppe, das N3-Atom und die Aminogruppe drei Wasserstoffbrücken mit der zugehörigen Guanin-Base des komplementären Stranges aus.
In die methylierte Form 5-Methylcytosin wird es durch Cytosin-spezifische Methyltransferasen umgewandelt.[13]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]
|

|
|

|

|

|

|

|

|
|

|

|
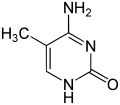
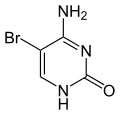
| 1-Methylcytosin | 3-Methylcytosin | 5-Methylcytosin | 5-Hydroxymethylcytosin | N4-Methylcytosin | N4,N4-Dimethylcytosin | Isocytosin | 5-Fluorcytosin | 5-Chlorcytosin | 5-Bromcytosin | 5-Iodcytosin | 5-Hydroxycytosin |
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu CYTOSINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 31. März 2020.
- ↑ a b c Eintrag zu Cytosin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ A. Abdelaziz, D.H. Zaitsau, T.A. Mukhametzyanov, B.N. Solomonov, P. Cebe, S.P. Verevkin, C. Schick: Melting temperature and heat of fusion of cytosine revealed from fast scanning calorimetry; in: Thermochim. Acta, 2017, 657, S. 47–55 (doi:10.1016/j.tca.2017.09.013).
- ↑ a b Datenblatt Cytosine bei Sigma-Aldrich, abgerufen am 23. November 2013 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Darstellung und Spaltungsproducte der Nucleinsäure (Adenylsäure). Vortrag in: Berichte der Deutschen Chemischen Gesellschaft, Band 27, 1894, Seite 2215.
- ↑ A. Kossel, H. Steudel: Weitere Untersuchungen über das Cytosin; in: Hoppe-Seyler´s Zeitschrift für physiologische Chemie, 1903, 38 (1–2), S. 49–59 (doi:10.1515/bchm2.1903.38.1-2.49).
- ↑ Weitere Untersuchungen über das Cytosin. In: Hoppe-Seyler`s Zeitschrift für physiologische Chemie, Band 38, 1903, Seite 49.
- ↑ A. Kossel, H. Steudel: Ueber einen basischen Bestandtheil thierischer Zellen; in: Hoppe-Seyler´s Zeitschrift für physiologische Chemie, 1903, 37 (2), S. 177–180 (doi:10.1515/bchm2.1903.37.2.177).
- ↑ H. L. Wheeler, T. B. Johnson: Synthesis of aminooxy-pyrimidines having the composition of cytosine, 2-amino-6-oxypyrimidine and 2-oxy-6-amino-pyrimidine; in: Am. Chem. J., 1903, 29, S. 492–504.
- ↑ M. Dreyfus, O. Bensaude, G. Dodin, J. E. Dubois: Tautomerism in Cytosine and 3-Methylcytosine. A Thermodynamic and Kinetic Study; in: J. Am. Chem. Soc., 1976, 98 (20), S. 6338–6349 (doi:10.1021/ja00436a045; PMID 965648).
- ↑ G. A. Wagner: Einführung in die Archäometrie, 1. Auflage, Springer Verlag, Berlin 2007, ISBN 3-540-71936-9, S. 282.
- ↑ J. R. Siewert, M. Rothmund, V. Schumpelick: Praxis der Viszeralchirurgie: Onkologische Chirurgie, 3. Auflage, Springer Verlag, Berlin 2010, ISBN 3-642-03807-7, S. 71.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Cytosine in der Human Metabolome Database (HMDB), abgerufen am 18. November 2013.