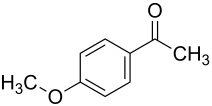
4-Methoxyacetophenon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Methoxyacetophenon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H10O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, angenehm riechende Tafeln[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,08 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
263 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
4-Methoxyacetophenon, auch p-Acetylanisol oder kurz Acetanisol, ist ein Methylketon des Anisols. Die Struktur leitet sich von der des Anisols ab und besitzt zusätzlich eine Acetylgruppe in para-Position zur Methoxygruppe. Es besitzt einen angenehm süßlichen Geruch, ähnlich dem von Weißdorn-Blüten bzw. Anisaldehyd.
Vorkommen und Verwendung
[Bearbeiten | Quelltext bearbeiten]In der Natur kommt es in Bibergeil, einem Drüsensekret des Bibers, vor. Es ist Nebenbestandteil von Medikamenten und wird als Riechstoff, zum Beispiel in Deodorants, verwendet.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Acetanisol wird aus Anisol und Acetylchlorid in einer Friedel-Crafts-Acylierung synthetisiert:
Eine umweltfreundlichere Alternative zur Verwendung von Aluminiumtrichlorid als Katalysator der Friedel-Crafts-Acylierung stellt die Katalyse mit Zeolithen dar.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Acetanisol ist eine farblose, kristalline Substanz mit süßem Geruch. Die Kristalle schmelzen schon bei geringer Erwärmung (ca. 38 °C).
Toxikologie
[Bearbeiten | Quelltext bearbeiten]In Studien mit Ratten bzw. Kaninchen wurden LD50-Werte von 1720 mg·kg−1 (oral)[5] bzw. > 5000 mg·kg−1 (perkutan)[6] ermittelt. Bei Untersuchungen im Jahr 1985 mit Menschen und Mäusen erzeugte die Substanz eine Erhöhung von Pulsfrequenz und Blutdruck beim Menschen sowie bei den Mäusen Schläfrigkeit und Muskelschwäche.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu METHOXYACETOPHENONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d e Eintrag zu 4-Methoxyacetophenon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- ↑ Jones AH; J Chem Eng Data 5: 196-200 (1960).
- ↑ a b Datenblatt 4′-Methoxyacetophenone bei Sigma-Aldrich, abgerufen am 18. März 2011 (PDF).
- ↑ a b c Gigiena i Sanitariya/HYSAAV, 1985, 50 (4), S. 86.
- ↑ a b Food and Cosmetics Toxicology. 12(927), 1974.
- ↑ Christoph Meier: "Green Chemistry" – von Anfang an in "Science Life" der ETH Zürich.

