Amminboran
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Amminboran | |||||||||||||||
| Andere Namen |
Borazan | |||||||||||||||
| Summenformel | BH6N | |||||||||||||||
| Kurzbeschreibung |
weißes bis beiges kristallines Pulver mit ammoniakartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 30,87 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
sehr gut löslich in Methanol, Tetrahydrofuran, Toluol, Methylenchlorid, löslich in Wasser, Diethylether, unlöslich in n-Hexan[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Amminboran ist eine chemische Verbindung aus der Gruppe der Borane. Amminboran ist das Lewis-Säure-Base-Addukt von Ammoniak NH3 an Monoboran BH3.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Amminboran lässt sich durch Umsetzung von Diboran(6) mit Ammoniak darstellen. In Abhängigkeit von den Reaktionsbedingungen tritt neben der symmetrischen Spaltung des Diborans(6) unter Bildung von Amminboran
die asymmetrische Spaltung unter Bildung der Verbindung Diammin-boronium-tetrahydridoborat [H2B(NH3)2]+(BH4)− auf:
Während [H2B(NH3)2]+(BH4)− bei der Einleitung von Diboran(6) in flüssigen Ammoniak bei einer Temperatur von −78 °C praktisch ausschließlich gebildet wird, wird Amminboran neben [H2B(NH3)2]+(BH4)− gebildet, wenn Diboran(6) in Ethern gelöst und Ammoniak diesen Lösungen zugesetzt wird. Ungefähr äquimolare Mengen an Amminboran und [H2B(NH3)2]+(BH4)− werden z. B. gebildet, wenn Ammoniak einer Lösung vom Diboran(6) in Tetrahydrofuran bei einer Temperatur von −78 °C durch Destillation zugesetzt wird.[5]
Durch Umsetzung von Stickstoff-verdünnten Gasströmen von Diboran(6) und Ammoniak im Verhältnis 17:1 ist reines Amminboran hergestellt worden.[6]
Eine weitere Herstellmethode ist die Umsetzung von Natriumborhydrid mit Ammoniumcarbonat in Tetrahydrofuran.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Amminboran hat eine Struktur ähnlich der von Ethan, wobei die große Differenz des Schmelzpunktes der beiden Verbindungen durch die stark polare Natur von Amminboran zustande kommt. Die B-N-Entfernung beträgt 1,58 Å, die B-H-Entfernung 1,15 Å und die N-H-Entfernung 0,96 Å.
Die Verbindung bildet farblose Kristalle. Sie tritt in zwei polymorphen Kristallformen auf. Bei einer Phasenübergangstemperatur von −49 °C wandelt sich die orthorhombische Tieftemperaturform in eine tetragonale Hochtemperaturform um. Die Umwandlungsenthalpie des Phasenübergangs liegt bei 1,48 kJ·mol−1.[8]
Chemische Eigenschaften
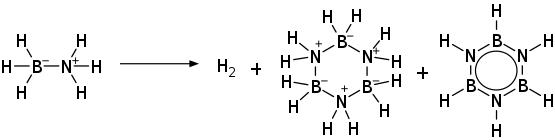
[Bearbeiten | Quelltext bearbeiten]Oberhalb von 80 °C erfolgt die thermische Zersetzung unter Freisetzung von 2,2 mol Wasserstoff pro Mol Borazan und der Bildung von Aminoboran (H2N–BH2) und Borazin. Die Reaktion verläuft mit einer Zersetzungswärme von −21,7 kJ·mol−1 bzw. −703 J·g−1 stark exotherm.[9][10] Die thermische Zersetzung kann auch in aprotischen Lösungsmitteln unter Bildung von Wasserstoff, Cyclotriborazan und Borazin durchgeführt werden.[11]
Mit der Freisetzung von bis zu 2,5 mol Wasserstoff pro Mol Borazan gelingt die Zersetzung auch kontrolliert bei moderater Temperatur von 60 °C in Lösung in Tetrahydrofuran/Diglyme in Gegenwart von Dibor-Lewis-Säure-Katalysatoren.[12] Die Verbindung ist hygroskopisch und setzt in Gegenwart von Luftfeuchte langsam Ammoniak und Wasserstoff frei.[3] Die Hydrolyse führt direkt zu Ammoniummetaborat und Wasserstoff.[13]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Amminboran wird als Speichersubstanz für Wasserstoffgas als Treibstoff für Fahrzeuge diskutiert.[14] Der Wasserstoff kann durch Erhitzung freigesetzt werden, wobei sich Amminboran zuerst zu (NH2BH2)n und dann zu (NHBH)n zersetzt.[15] Die Wasserstoffspeicherdichte von Amminboran ist höher als die von flüssigem Wasserstoff.[16]
Amminboran wird auch bei organischen Synthesen als mildes Reduktionsmittel und stabile Variante von Diboran eingesetzt. Die Reduktionseigenschaften entsprechen dem von Natriumborhydrid. Aus aliphatischen und aromatischen Ketonen, Aldehyden und Enonen werden mit guter Ausbeute die entsprechenden Alkohole erhalten.[17][3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Ammonia borane (GfsChemicals) ( vom 17. Januar 2016 im Internet Archive) (PDF; 43 kB, englisch)
- ↑ Datenblatt Borane-ammonia complex bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- ↑ a b c e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Borane-Ammonia, abgerufen am 19. September 2022.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Ammonia borane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 20. Oktober 2023.
- ↑ S.G. Shore, K.W. Boeddeker: Large Scale Synthesis of H2B(NH3)2+BH4− and H3NBH3. In: Inorganic Chemistry. 1964, 3, S. 914–15, doi:10.1021/ic50016a038.
- ↑ Song, Y., Ma, N., Ma, X., Fang, F., Chen, X., Guo, Y.: Synthesis of ammonia borane nanoparticles and the diammoniate of diborane by direct combination of diborane and ammonia, Chemistry–A European Journal, 2016, 22(18), S. 6228–6233; doi:10.1002/chem.201600367
- ↑ M.G. Hu, J.M. Van Paaschen, R.A. Geanangel: New synthetic approaches to ammonia-borane and its deuterated derivatives in J. Inorg. Nucl. Chem. 39 (1977) 2147–2150, doi:10.1016/0022-1902(77)80383-7.
- ↑ G. Wolf, J.C. van Miltenburg, U. Wolf: Thermochemical investigations on borazane (BH3–NH3) in the temperature range from 10 to 289 K in Thermochim. Acta 317 (1998) 111–116, doi:10.1016/S0040-6031(98)00381-5.
- ↑ G. Wolf, J. Baumann, F. Baitalow, F.P. Hoffmann: Calorimetric process monitoring of thermal decomposition of B–N–H compounds in Thermochim. Acta 343 (2000) 19–25, doi:10.1016/S0040-6031(99)00365-2.
- ↑ F. Baitalow, J. Baumann, G. Wolf, K. Jaenicke-Rößler, G. Leitner: Thermal decomposition of B–N–H compounds investigated by using combined thermoanalytical methods in Thermochim. Acta 391 (2002) 159–168, doi:10.1016/S0040-6031(02)00173-9.
- ↑ J.S. Wang; R.A. Geanangel: 11B–NMR studies of the thermal decomposition of ammonia–borane in solution in Inorg. Chim. Acta 148 (1988) 185–190, doi:10.1016/S0020-1693(00)87499-X.
- ↑ Z. Lu, L. Schweighauser, H. Hausmann, H.A. Wegner: Metallfreie Amminboran-Dehydrierung katalysiert durch eine Dibor–Lewis–Säure in Angew. Chem. 127 (2015) 15777–15780, doi:10.1002/ange.201508360.
- ↑ M. Chandra; Q. Xu: Dissociation and hydrolysis of ammonia-borane with solid acids and carbon dioxide: An efficient hydrogen generation system in J. Power Sources 159 (2006) 855–860, doi:10.1016/j.jpowsour.2005.12.033.
- ↑ Wiedergeburt für Wasserstofftanks (Technology Review).
- ↑ Maciej Gutowski: Hydrogen gets on board. In: Chemistry World. 3. März 2006, abgerufen am 20. Dezember 2023 (englisch).
- ↑ Frances H. Stephens, Vincent Pons, R. Tom Baker: Ammonia borane: the hydrogen source par excellence?. In: Dalton Transactions, 2007, S. 2613–2626, doi:10.1039/b703053c.
- ↑ G.C. Andrews: Borane Ammonia. In Encyclopedia of Reagents for Organic Synthesis, 2004, doi:10.1002/047084289X.rb238.pub2.



![{\displaystyle \mathrm {\ B_{2}H_{6}\ +\ 2\ NH_{3}\longrightarrow [H_{2}B(NH_{3})_{2}][BH_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2cb6c5a09622fe6171ab612f47c17634cd93ec41)