Ammoniumdichromat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
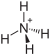 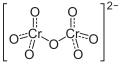
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumdichromat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | (NH4)2Cr2O7 | ||||||||||||||||||
| Kurzbeschreibung |
orangefarbener, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 252,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,15 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
170 °C[1] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (360 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR)[4]; zulassungspflichtig[5] | ||||||||||||||||||
| MAK |
Schweiz: 5 μg·m−3 (berechnet als Chrom)[6] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ammoniumdichromat ist das Ammoniumsalz der in nur wässrigen Lösung bekannter Dichromsäure. Es besitzt die Formel (NH4)2Cr2O7.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Ammoniumdichromat ist ein orangefarbenes Pulver, das gut in Wasser löslich ist.
Auf Grund seiner Zusammensetzung aus einem leicht oxidierbaren Kation (Ammoniumion) und einem starken Oxidationsmittel (Dichromat) kann es sich exotherm zersetzen.
Das bekannteste Experiment zur Zersetzung von kristallinem Ammoniumdichromat ist der Vulkanversuch. Dabei wird ein größerer Kristall oder ein kleines Häufchen oben entzündet.[8] Nach dem Entzünden schreitet die Reaktion unter lebhaftem Glühen, Rauschen (Stickstoffentwicklung) und der Bildung von lockerem graugrünem Chrom(III)-oxid fort. Das gebildete Chrom(III)-oxid quillt wie Vulkanasche aus der Reaktionsstelle hervor und bildet so einen Kegel. Die entsprechende Reaktionsgleichung für diese Reaktion lautet:
Der Vulkanversuch ist an deutschen Schulen aufgrund der Bildung von Chrom(III)-chromat untersagt.[9]
Insgesamt ist Ammoniumdichromat ein starkes Oxidationsmittel, das mit starken Reduktionsmitteln wie zum Beispiel fein verteilten Metallpulvern, Schwefel oder Phosphor sehr heftig (explosiv) reagiert.
Wegen seiner ionischen Natur und den in Wasser ausgebildeten Dissoziationsgleichgewichten wirkt das Ammoniumdichromat ätzend.
Explosive Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumdichromat zersetzt sich ab 100 °C exotherm; zwischen 130 und 180 °C tritt Selbstentzündung ein, die Reaktion verläuft auch in Abwesenheit von Sauerstoff ab 240 °C explosiv.[2] Bei einer Initialzündung mittels Pikrinsäure detoniert es auch unter Verdämmung nur unvollständig.[10]
Die Empfindlichkeit gegenüber mechanischer Beanspruchung ist äußerst gering. So reagiert Ammoniumdichromat beim Zerreiben im nichtglasierten Mörser gar nicht; die Empfindlichkeit gegenüber Schlag entspricht in etwa der von Ammoniumperchlorat (15 cm unter einem 10 kg-Fallhammer; das nicht als explosionsgefährlich eingestufte Ammoniumnitrat detoniert unter dem 10 kg-Fallhammer aus einer Höhe von 20 cm). Die Detonation pflanzt sich auch unter optimalen Bedingungen nur auf sehr kurze Strecken fort.[11][12]
Ammoniumdichromat ist kein Sprengstoff, findet jedoch vereinzelt in pyrotechnischen Sätzen sowie als Katalysator in Treibmitteln auf Ammoniumnitrat-Basis Verwendung.[13]
Verwendung
[Bearbeiten | Quelltext bearbeiten]- In der Analogfotografie, Holographie und den Edeldruckverfahren (besonders im Lichtdruck und Gummidruck sowie (zusammen mit Gelatine, Polyvinylalkohol und ggf. Farbstoffen) den sogenannten „dichromated gelatin“(DCG)-Hologrammen[14]):
Ammoniumdichromat gerbt unter Lichteinwirkung Gelatine oder andere Kolloide, wodurch diese lichtempfindlich und nach Belichtung und Entwicklung selbst zur Farbschicht oder aber zum Farbträger oder Hologramm[15] werden. - In pyrotechnischen Erzeugnissen.
- Zur Herstellung von Holzschutzmitteln für industrielle Anwendung.
- Zur Herstellung von Chrom(IV)-oxid für magnetische Datenträger.
- Zur Herstellung von Katalysatoren für organische Synthesen.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Ammoniumdichromat kann durch die Reaktion von Chrom(VI)-oxid in einer konzentrierter Ammoniaklösung gewonnen werden:
Oder alternativ auch durch Ammoniumchromat und 35 Prozent Essigsäure:
Ammoniumchromat reagiert mit Essigsäure zu Ammoniumdichromat, Ammoniumacetat und Wasser
Toxikologie und Ökotoxikologie
[Bearbeiten | Quelltext bearbeiten]Ammoniumdichromat ist toxikologisch von der EU-Kommission als Krebserzeugend Kategorie 1B (H350: Kann Krebs erzeugen), Mutagen Kategorie 1B (H340: Kann genetische Defekte verursachen) und Reproduktionstoxisch Kategorie 1B (H360FD: Kann die Fruchtbarkeit beeinträchtigen. Kann das Kind im Mutterleib schädigen) eingestuft.
Weiterhin ist es als lebensgefährlich beim Einatmen (H330) und giftig beim Verschlucken (H301) eingestuft. Der Kontakt mit der Haut wird als gesundheitsschädigend (H312) bewertet. Eine weitere Gefahr von Ammoniumdichromat stellt die Möglichkeit einer Sensibilisierung durch Einatmen und Hautkontakt (H334/317) dar.
Ökotoxikologisch gilt es als sehr giftig für Wasserorganismen und kann eine längerfristige schädigende Wirkung auf Gewässer haben (H410). In der Verwaltungsvorschrift wassergefährdender Stoffe (VwVwS Stand Juli 2005) ist Ammoniumdichromat mit der Kenn-Nummer 290 in die höchste Wassergefährdungsklasse 3 eingestuft. Auf Grund des in der Literatur angegebenen Biokonzentrationsfaktors von 200–2000 ist eine Anreicherung in Organismen möglich.
Gesetzliche Beschränkungen
[Bearbeiten | Quelltext bearbeiten]Ammoniumdichromat wurde im Juni 2010 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B), mutagen (Muta. 1B) und reproduktionstoxisch (Reprod. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[4] Im April 2013 wurde Ammoniumdichromat danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. September 2017 aufgenommen.[5][17] Als Chrom(VI)-Verbindung unterliegt Ammoniumdichromat außerdem den Beschränkungen im Anhang XVII, Nummer 47 und 72 der REACH-Verordnung (in Deutschland umgesetzt durch die Chemikalien-Verbotsverordnung).[18] Ammoniumdichromat unterliegt dem Wasserhaushaltsgesetz und dem Sprengstoffgesetz und in industriellen Mengen außerdem der Störfallverordnung. Weiterhin bestehen Beschäftigungsbeschränkungen für Jugendliche (Jugendarbeitsschutzgesetz), sowie für werdende und stillende Mütter (Mutterschutzrichtlinie).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Ammonium dichromate bei Alfa Aesar, abgerufen am 14. Januar 2020 (Seite nicht mehr abrufbar).
- ↑ a b c Eintrag zu Ammoniumdichromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Januar 2020. (JavaScript erforderlich)
- ↑ Eintrag zu Ammonium dichromate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ a b Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Chrom(VI)-Verbindungen), abgerufen am 27. Oktober 2015.
- ↑ Eintrag zu Ammoniumdichromat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2015.
- ↑ Michael Binnewies et alii: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6, S. 676.
- ↑ Unterricht in Schulen mit gefährlichen Stoffen (Online-Fassung; PDF; 10,0 MB), S. 21, Fußnote 2, abgerufen am 25. April 2011. Jedoch entstehen laut Gmelin nur Chrom(III)-oxid, Stickstoff und Wasserdampf. Auch nach jüngeren wissenschaftlichen Untersuchungen (D. DeWaal et al., Journal of Solid State Chemistry 80, 170 (1989)) konnte keine Bildung des befürchteten (als CMR-Stoff im Chemikalienrecht Verwendungsbeschränkungen unterliegenden) Chrom(III)-chromats nachgewiesen werden.
- ↑ Tadeusz Urbanski: Chemistry and Technology of Explosives. Vol. II, Pergamon Press, 1965, S. 490.
- ↑ H. Kast; In: Z. ges. Schieß- und Sprengstoffwesen. 22 [1927] 6/9: „Unter der Wrkg. der Detonation von 30g gepreßter Pikrinsäure auf das in ein 4 cm weites, 4 mm starkes und 18 cm langes Rohr (vermutlich Zn-Rohr) gestopfte Salz tritt nur entlang einer kurzen Strecke Zerfall der Verb. ein.“
- ↑ Leopold Gmelin: Gmelins Handbuch der anorganischen Chemie. 8. Auflage. Syst.Nr. 52, S. 714.
- ↑ Josef Köhler: Explosivstoffe. Wiley-VCH, 2008, S. 17.
- ↑ K.Kurokawa et al., Applied Optics 37, 3038 (1998).
- ↑ KUBOTA HOLOGRAPHY LAB: Beispiele von DCG-Hologrammen, abgerufen am 3. Juni 2013.
- ↑ Arthur A. Blanchard, Joseph W. Phelan, Arthur R. Davis: Synthetic Inorganic Chemistry. New York 1936, S. 327 f.
- ↑ Verordnung (EU) Nr. 348/2013
- ↑ ECHA: Liste der beschränkten Stoffe – Anhang XVII der REACH-Verordnung, abgerufen am 5. September 2020.
- Brandfördernder Stoff
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Ätzender Stoff
- Sensibilisierender Stoff
- Giftiger Stoff bei Einatmen
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Zulassungspflichtiger Stoff nach REACH-Anhang XIV
- Ammoniumverbindung
- Chromat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 29
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 47
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)







