Resorcin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Resorcin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
große, farblose, süß schmeckende Nadeln[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 110,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,28 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
277 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Resorcin (1,3-Dihydroxybenzol, 1,3-Benzoldiol) leitet sich formal vom Benzol ab. Der Benzolkern trägt zwei Hydroxygruppen in meta-Stellung. Es gehört zur Stoffgruppe der Phenole (Diphenole) und ist isomer zu Brenzcatechin (1,2-Dihydroxybenzol) und Hydrochinon (1,4-Dihydroxybenzol).
Geschichte
[Bearbeiten | Quelltext bearbeiten]Erstmals wurde Resorcin im Jahr 1864 von den österreichischen Chemikern Heinrich Hlasiwetz und Ludwig Barth zu Barthenau am Universitätslaboratorium Innsbruck aus dem weihrauchähnlichen Galbanumharz isoliert.[7][8]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Natürlich kommt Resorcin im Holz der Roteiche vor.[9]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Resorcin kann man durch Destillation von Naturharzen (lateinisch resina) gewinnen.
Technisch stellt man es durch Schmelzen von m-Benzoldisulfonsäure mit Natriumhydroxid (Alkalischmelze) her. Dabei fällt Natriumsulfit als Nebenprodukt an.

Heute ist das Alkalischmelze-Verfahren wegen der damit verbundenen hohen Salzfrachten obsolet und in der industriellen Praxis durch das von Heinrich Hock entwickelte und von den japanischen Firmen Sumitomo Chemical und Mitsui Chemicals adaptierte Cumolhydroperoxid-Verfahren ersetzt worden.[10] Dabei wird 1,3-Diisopropylbenzol in der Flüssigphase bei Temperaturen von 80 bis 100 °C mit Luftsauerstoff zum 1,3-Diisopropylbenzol-dihydroperoxid (m-DHP) oxidiert und nach Abtrennung der Nebenprodukte in homogener Phase mit Schwefelsäure[11] oder heterogen an sauren Alumosilikaten[12] mit praktisch quantitativen Ausbeuten zu Resorcin und Aceton umgelagert.

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Resorcin löst sich leicht in Wasser, Ethanol und Ether. Bei 20 °C lösen sich in 1 Liter Wasser 1400 Gramm Resorcin. Die gute Löslichkeit in Wasser wird vor allem durch Wasserstoffbrückenbindungen zwischen den beiden phenolischen Hydroxygruppen und den Lösemittelmolekülen verursacht.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mit Eisen(III)-chlorid-Lösung geht Resorcin eine für die Phenole charakteristische Farbreaktion ein; es bildet sich eine tiefviolette Lösung.
Wie alle Phenole wirkt Resorcin schwach sauer, da die phenolischen Hydroxygruppen leichter deprotoniert werden als alkoholische; die Säurekonstante für die erste Protolysestufe beträgt pKs = 9,48.[4]
Im Gegensatz zu Brenzcatechin und Hydrochinon wirkt Resorcin nur schwach reduzierend und fällt aus ammoniakalischer Silbernitratlösung kein elementares Silber aus. Erst in der Hitze scheidet sich schwarzes Silber ab.
Auch eine alkalische Lösung färbt sich an der Luft nur sehr langsam gelb. Alkalische Lösungen von Brenzcatechin und Hydrochinon verfärben sich dagegen durch Einwirkung des Sauerstoffs rasch braun.
Außerdem lässt sich Resorcin zur Unterscheidung von Fructose und Glucose heranziehen. Mischt man Fructose, Resorcin und konzentrierte Salzsäure zusammen, ergibt sich eine markante Rotfärbung (Seliwanow-Probe). Dieser Nachweis ist äußerst hilfreich, da Fructose, als Ketohexose, eine positive Fehling-Probe liefert, aufgrund der leichten Umwandlung von Fructose zu Glucose, oder auch halbacetalische OH-Gruppen ausbildet.
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Natriumamalgam reduziert das Resorcin zum Dihydroresorcin (1,3-Cyclohexandion),[13] das mit konzentrierter Bariumhydroxidlösung beim Erhitzen auf 150–160 °C in 4-Acetylbuttersäure (5-Oxohexansäure, CAS-Nummer: 3128-06-1) übergeht.[14]

Mit Bromwasser bildet sich 2,4,6-Tribromresorcin.[15][16] Wenn Brom im Überschuss eingesetzt wird, reagiert das 2,4,6-Tribromresorcin zu 2,4,4,6,6-Pentabrom-1-cyclohexen-3,5-dion weiter.[17] Durch Zugabe von Kaliumiodid kann diese Reaktion rückgängig gemacht werden.

Mit Säuren und Säurechloriden findet in Gegenwart wasserentziehender Mittel Acylierung statt, so entsteht bei der Reaktion mit Eisessig mit Zinkchlorid als Katalysator bei 145 °C Resacetophenon.[18]

Mit den Anhydriden zweibasiger Säuren entstehen Fluoresceine, z. B. aus Phthalsäureanhydrid entsteht Fluorescein:[19][20]

Mit Natriumnitrit bildet sich eine wasserlösliche, blaue Substanz, die sich bei Säurezugabe rot färbt. Diese Substanz wird als Lacmoid oder Resorcinblau bezeichnet und als Indikator eingesetzt.[21]

Resorcin kondensiert mit Aldehyden, so bildet sich mit Formaldehyd in Gegenwart von Salzsäure als Katalysator das Methylendiresorcin. Mit Chloralhydrat bildet sich in Anwesenheit von Kaliumbisulfat als Katalysator das Lacton der Tetraoxydiphenylmethancarbonsäure.[22]

In alkoholischer Lösung kondensiert Resorcin mit Natriumacetylacetat zu Methylumbelliferon.[23]

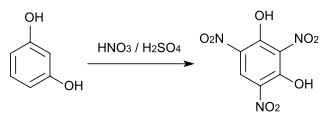
Trinitroresorcin (Styphninsäure) wird bei Reaktion mit konzentrierter Salpetersäure und kalter konzentrierter Schwefelsäure gebildet. Styphninsäure und vor allem sein Bleisalz werden als Sprengstoffe eingesetzt.
Durch Carboxylierung mit Kaliumhydrogencarbonat kann in einer Kolbe-Schmitt-Reaktion 2,4-Dihydroxybenzoesäure hergestellt werden.[24]

Mit Aldehyden kann Resorcin unter Brønstedt-Säurekatalyse zu Resorcinarene kondensieren.
Metabolismus und Toxizität
[Bearbeiten | Quelltext bearbeiten]Resorcin bildet in Ratten in Studien hauptsächlich Glucoroidkonjugate.[25] Generell wird Resorcinol wie andere Dihydroxybenzene auch als toxischer als Phenol betrachtet. Im Vergleich zu anderen Dihydroxybenzenen gilt es aber als weniger giftig.[26][27]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Resorcin wird zur Herstellung von Farbstoffen, besonders Triphenylmethanfarbstoffen (Fluorescein, Eosin Y), und Kunststoffen (Phenoplaste) verwendet. Hauptverwendung von Resorcin und Resorcinharzen ist die Haftvermittlung zwischen den Gewebeeinlagen oder Stahlcord mit den Gummicompounds im Reifenbau (RFL-Dip). Resorcinformaldehydharze (Phenol-Resorcin-Formaldehyd-Kleber) werden als Klebstoff bei der Herstellung von Sperrholz und anderen Holzaufbauten verwendet. Neuere Anwendungen sind Flammschutzmittel auf Phosphorsäureesterbasis und lichtbeständige, transparente Polymere.
Pharmakologische Wirkung
[Bearbeiten | Quelltext bearbeiten]In hohen Dosen ist Resorcin giftig, in verdünnten Lösungen entfaltet es antiseptische Wirkung und wird daher in der Dermatologie zur Heilung von Ekzemen in Salben oder Haarwässern verwendet, wie auch als Keratolytikum bei Dermatosen der behaarten Kopfhaut.
Die Einnahme von zu hohen Dosen von Resorcin führt zu schweren Vergiftungserscheinungen, wie Hypothermie, Hypotension, Atembeschwerden und in Kindern auch zu Hämoglobinurie.[28] Auch nach einer Verwendung in oben beschriebenen Salben kann es zu einer Intoxikation führen.[29] In seltenen Fällen verursacht Resorcin Irritationen der Haut oder sogar Kontaktdermatitis.[30][31]
In Tierversuchen an Ratten zeigte sich ab einer Dosis von 260 mg/kg KG täglich eine erhöhte Sterblichkeit. Bei niedrigeren Dosen zeigten Studien auch über einen längeren Beobachtungszeitraum keine erhöhte Sterblichkeit unter Ratten.[32]
Gefahrenbewertung
[Bearbeiten | Quelltext bearbeiten]Resorcin wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Resorcin waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie als potentieller endokriner Disruptor. Die Neubewertung fand ab 2016 statt und wurde von Finnland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[33][34]
2019 wurde Resorcin erneut in die CoRAP-Liste aufgenommen. Ursächlich hierfür waren weiterhin die Besorgnisse bezüglich hoher (aggregierter) Tonnage und als potentieller endokriner Disruptor. Die Neubewertung lief seit 2019 und wurde von Frankreich durchgeführt.[34] Im Anhang-XV-Bericht kam Frankreich 2020 zum Schluss, dass Resorcin in Bezug auf sein schilddrüsenschädigendes Potenzial wahrscheinlich schwerwiegende Auswirkungen auf die menschliche Gesundheit hat.[35] Diese Position wurde zwar von einer Mehrheit des Ausschusses der Mitgliedstaaten gestützt,[36] da aber kein Konsens erreicht werden konnte, wurde Resorcin bisher (Stand 03/2022)[37] nicht als SVHC eingestuft, sondern lediglich zur Entscheidung an die Europäische Kommission weiter verwiesen.[38]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu RESORCINOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- ↑ a b c Eintrag zu Resorcin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2014.
- ↑ a b c d e f g h i j Eintrag zu Resorcin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Eintrag zu Resorcinol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-46-3 bzw. Resorcin), abgerufen am 2. November 2015.
- ↑ Hlasiwetz, H.; Barth, L.: Ueber einen neuen, dem Orcin homologen Körper in Liebigs Ann. Chem. 130, 1864, S. 354–359. Link.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 146 PDF.
- ↑ RESORCIN (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. Juli 2023.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, 6. Aufl. Wiley-VCH Verlag, Weinheim 2007, ISBN 978-3-527-31540-6, S. 404–405.
- ↑ Patentanmeldung DE2357845A1: Verfahren zur Spaltung von Diisopropylbenzoldihydroperoxiden. Angemeldet am 20. November 1973, veröffentlicht am 20. Juni 1974, Anmelder: Sumitomo Chemical Co, Erfinder: Hideaki Suda et al.
- ↑ Patentanmeldung DE2843754A1: Verfahren zur Herstellung von Resorcin. Angemeldet am 6. Oktober 1978, veröffentlicht am 12. April 1979, Anmelder: Mitsui Petrochemical Industries Ltd, Erfinder: Thoru Taguchi et al.
- ↑ G. Merling: Ueber Dihydroresorcin. In: Justus Liebigs Annalen der Chemie. Band 278, Nr. 1, Januar 1894, S. 20–57, doi:10.1002/jlac.18942780103.
- ↑ Ralf Krelaus: Synthese von bicyclischen Lactamen durch Ugi-Reaktion und Ringschlußmetathese. Paderborn 2003, DNB 968549772, urn:nbn:de:hbz:466-20030101177 (Dissertation, Universität Paderborn).
- ↑ Timo Liebig: Konkave N-heterocyclische Katalysator-Systeme. Kiel 2006, DNB 980883172, urn:nbn:de:gbv:8-diss-17594 (Dissertation, Universität Kiel).
- ↑ Michael Abbass: Konkave 1,10-Phenanthroline mit zusätzlicher Funktionalität in 4'-Position. Kiel 2002, DNB 971656959, urn:nbn:de:gbv:8-diss-5710 (Dissertation, Universität Kiel).
- ↑ H. P. Latscha, H. A. Klein, G. W. Linti: Analytische Chemie (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. Nencki, N. Sieber: Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen. In: Journal für Praktische Chemie. Band 23, Nr. 1, 1880, S. 147–156 (Digitalisat auf Gallica).
- ↑ Arbeitsvorschrift auf www.oc-praktikum.de (PDF; 117 kB).
- ↑ Reaktionsmechanismus für die Bildung von Fluorescein ( vom 15. April 2010 im Internet Archive) (MS Word; 52 kB).
- ↑ M. C. Traub, C. Hock: Ueber ein Lakmoid. In: Berichte der deutschen chemischen Gesellschaft. Band 17, Nr. 2, Juli 1884, S. 2615–2617, doi:10.1002/cber.188401702192.
- ↑ J. T. Hewitt, F. G. Pope The condensation of chloral with resorcinol. In: Journal of the Chemical Society, Transactions. Nr. 75, 1897, S. 1084–1090, doi:10.1039/CT8977101084.
- ↑ Arthur Michael: Ueber das Verhalten von Natriummalonäther gegen Resorcinol. In: Journal für Praktische Chemie. Band 37, Nr. 1, 1888, S. 469–471 (Digitalisat auf Gallica).
- ↑ M. Nierenstein, D. A. Clibbens: β-Resorcylic Acid In: Organic Syntheses. 10, 1930, S. 94, doi:10.15227/orgsyn.010.0094; Coll. Vol. 2, 1943, S. 557 (PDF).
- ↑ P. C. Merker, D. Yeung, D. Doughty, S. Nacht: Pharmacokinetics of resorcinol in the rat. In: Research Communications in Chemical Pathology and Pharmacology. Band 38, Nr. 3, Dezember 1982, S. 367–388, PMID 7163635.
- ↑ S. Suresh, Vimal Chandra Srivastava, Indra Mani Mishra: Study of Catechol and Resorcinol Adsorption Mechanism through Granular Activated Carbon Characterization, pH and Kinetic Study. In: Separation Science and Technology. Band 46, Nr. 11, 1. Juli 2011, S. 1750–1766, doi:10.1080/01496395.2011.570284.
- ↑ Kroschwitz, Jacqueline I., Seidel, Arza: Kirk-Othmer encyclopedia of chemical technology. 5th ed Auflage. Nr. 11. Hoboken, N.J., ISBN 978-0-471-48494-3, S. 462.
- ↑ World Health Organization Staff, International Agency for Research on Cancer (IARC): Some Fumigants, the Herbicides 2, 4-D and 2, 4, 5-T, Chlorinated Dibenzodioxins and Miscellaneous Industrial Chemicals. World Health Organization, Geneva 1977, ISBN 92-832-1215-0.
- ↑ International Agency for Research on Cancer: Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. World Health Organization, International Agency for Research on Cancer, [Lyon, France] 1999, ISBN 978-92-832-1271-3.
- ↑ J. Vilaplana, C. Romaguera, F. Grimalt: Contact dermatitis from resorcinol in a hair dye. In: Contact Dermatitis. Band 24, Nr. 2, Februar 1991, S. 151–152, doi:10.1111/j.1600-0536.1991.tb01682.x.
- ↑ Luigi Massone, Antonio Anonide, Susanna Borghi, David Usiglio: Contact dermatitis of the eyelids from resorcinol in an ophthalmic ointment. In: Contact Dermatitis. Band 29, Nr. 1, Juli 1993, S. 49–49, doi:10.1111/j.1600-0536.1993.tb04545.x.
- ↑ National Toxicology Program: Toxicology and Carcinogenesis Studies of Resorcinol (CAS No. 108-46-3) in F344 Rats and B6C3F1 Mice (Gavage Studies). In: National Toxicology Program Technical Report Series. Band 403, Juli 1992, S. 1–234, PMID 12621515.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ a b Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Resorcinol, abgerufen am 26. März 2019.
- ↑ Frankreich: Annex XV report – PROPOSAL FOR IDENTIFICATION OF A SUBSTANCE OF VERY HIGH CONCERN ON THE BASIS OF THE CRITERIA SET OUT IN REACH ARTICLE 57. echa.europa.eu, Februar 2020, abgerufen am 1. März 2022.
- ↑ OPINION OF THE MEMBER STATE COMMITTEE ON THE IDENTIFICATION OF RESORCINOL AS A SUBSTANCE OF VERY HIGH CONCERN. echa.europa.eu, 12. Juni 2020, abgerufen am 2. März 2022.
- ↑ Liste der für eine Zulassung in Frage kommenden besonders besorgniserregenden Stoffe. In: echa.europa.eu. Abgerufen am 19. Januar 2022.
- ↑ Resorcinol not identified as a substance of very high concern. In: echa.europa.eu. 16. Juni 2020, abgerufen am 8. März 2022.
- CoRAP-Stoff
- ATC-D10
- Gesundheitsschädlicher Stoff bei Verschlucken
- Hautreizender Stoff
- Sensibilisierender Stoff
- Ätzender Stoff
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Arzneistoff
- Resorcin
- Sekundärer Pflanzenstoff
- Nachweisreagenz
- Aromastoff (EU)
- Futtermittelzusatzstoff (EU)



