Malolaktische Gärung
| Übergeordnet |
| Gärung Metabolismus der L-Milchsäure |
| Gene Ontology |
|---|
| QuickGO |
Die malolaktische Gärung tritt bei vielen heterofermentativen Milchsäurebakterien und Hefen auf und spielt bei der Wein-, Fruchtsaft- und Champagnerherstellung eine Rolle. Sie wird auch als biologischer Säureabbau (BSA) oder Äpfelsäure-Milchsäure-Gärung bezeichnet. Die malolaktische Gärung ist eine sekundäre Gärung, die als Folge den Abbau von Säure im Medium hat. Sie folgt einer primären, Alkohol erzeugenden Gärung. Bei der malolaktischen Gärung decarboxylieren bestimmte Milchsäurebakterien die Dicarbonsäure L-Malat (= deprotonierte Form der L-Äpfelsäure) unter Energiegewinnung zur schwächeren Monocarbonsäure L-Lactat (= deprotonierte Form der L-Milchsäure). Durch die Backhefe Saccharomyces cerevisiae wird die Milchsäure weiter zu Ethanol abgebaut und vergoren.
Der durch diese Gärung resultierende biologische Säureabbau führt bei der Weinherstellung zu einem harmonischen und ausgewogeneren Geschmacksbild – ein Effekt, der sich qualitätssteigernd auswirkt, der aber auch Risiken birgt: Säurearme Weine sind weniger haltbar, weniger „spritzig“ und wirken nicht so frisch. Eine zu weit getriebene malolaktische Gärung kann zudem zu einem an Milch oder Käse erinnernden störenden Beigeschmack führen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Die malolaktische Gärung findet in vielen Mikroorganismen statt, die zur Energiegewinnung eine heterofermentative Gärung betreiben. Für die Weinherstellung ist Oenococcus oeni (alte Bezeichnung Leuconostoc oenos) bedeutsam, ferner Lactobacillus spp. (z. B. Lactobacillus plantarum) und Pediococcus spp.[1]
Auch Hefen wie Saccharomyces cerevisiae können am Ende der alkoholischen Gärung malolaktische Gärung betreiben.
Biochemie
[Bearbeiten | Quelltext bearbeiten]Prozess
[Bearbeiten | Quelltext bearbeiten]| vorher [g·l−1] |
nachher [g·l−1] | |
| Äpfelsäure | 3,2 | 0,5 |
| Milchsäure | 0,12 | 1,8 |
| Säure gesamt | 4,9 | 3,8 |
Bei der malolaktischen Gärung wird die Decarboxylierung von L-Malat zu L-Lactat katalysiert. Abhängig vom pH-Wert des Mediums kann Malat bzw. Lactat auch protoniert vorliegen
Bei dieser Reaktion wird mit jedem Gramm abgebauter Äpfelsäure der Gesamtanteil der Säure im Wein um 0,4 g/LH2SO4 gesenkt.
S. cerevisiae baut Malat über ein NADH-abhängiges Malatenzym zu Lactat ab. Hierbei wird NADH erzeugt. Lactat wird schließlich zu Ethanal decarboxyliert, das dann zu Ethanol reduziert wird. Die Reduktion erfordert NADH. Daher kann man strenggenommen nur beim Malatabbau in Hefen von einer Gärung sprechen, während es Bakterien decarboxylieren.
Energiegewinnung
[Bearbeiten | Quelltext bearbeiten]Unter Standardbedingungen wird bei der Decarboxylierungsreaktion Energie freigesetzt. Dieser Wert ist vom pH-Wert abhängig. Bei pH 7 werden 26,5 kJ·mol−1, bei einem pH-Wert von 5,7 werden 33,9 kJ·mol−1 freigesetzt.[2] In Weinen kann der pH-Wert durchaus bei 3,5 liegen, dann werden unter Standardbedingungen 46,5 kJ·mol−1 frei. Es ist jedoch anzumerken, dass unter physiologischen Bedingungen Malat, Lactat und CO2 nicht in einer Konzentration von 1 mol·l−1 vorliegen und während des Prozesses ständig Malat verbraucht und Lactat erzeugt wird. Daher ist der Energiegewinn unter physiologischen Bedingungen geringer.[3]
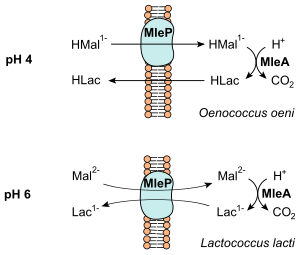
Die bei der Decarboxylierung freigesetzte Energie wird in Form eines chemiosmotischen Mechanismus konserviert (vgl. Abbildung).[4] Bei O. oeni, der bei einem pH-Wert von etwa 4 wächst, wird einfach protoniertes Malat (HMal1−) durch einen membranständigen Carrier (MleP) in die Zelle gebracht.[1] Dieses wird zu Lactat decarboxyliert, welches bei pH 4 protoniert (HLac) vorliegt. Der Ausstrom aus der Zelle bei HLac erfolgt ohne Carrier. Lactococcus lactis wächst unter höheren pH-Werten und Malat (Mal2−) wird mit Lactat (Lac1−) durch einen Antiporter (MleP) ausgetauscht.
In beiden Fällen wird im Netto eine (negative) Ladung transportiert, was zu einer Energetisierung der Membran führt. Darüber hinaus wird im Zuge der Decarboxylierung ein Proton verbraucht, so dass auch ein Protonenkonzentrationsunterschied aufgebaut werden kann. Beide Prozesse führen daher zu einem Aufbau eines elektrochemischen Gradienten (proton motive force). Er wird von den Bakterien zur Aufrechterhaltung des pH-Wertes und zur Aufnahme von Nährstoffen genutzt. Jedoch reicht die bei der malolaktischen Gärung freigesetzte Energie nicht als einzige Energiequelle aus, so dass die heterofermentativen Milchsäurebakterien weiterhin auf die Vergärung von Pentosen bzw. Hexosen angewiesen sind.[4]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Ende des 19. Jahrhunderts wurde durch Alfred Koch der Beweis erbracht, dass Bakterien für die Säureverringerung in Weinen verantwortlich sind. Diese Erkenntnisse wurden 1900 während einer Konferenz des deutschen Weinbaukongresses in Colmar veröffentlicht.[5] Weitere Erkenntnisse, z. B. die negativen Auswirkungen des bakteriellen Säureabbaus, fassten 1913 Hermann Müller (Thurgau) und Adolf Osterwalder in einer Veröffentlichung zusammen.[6]
Obwohl die chemische Reaktion seit Anfang der 1920er Jahre durch Arbeiten von Wenzel Seifert an der Höheren Bundeslehranstalt und Bundesamt für Wein- und Obstbau in Klosterneuburg bekannt war, brauchte es noch nahezu 40 Jahre zum tieferen Verständnis des biologischen Säureabbaus.
Dass der Malatabbau auch von Hefen verursacht werden kann, wurde von Paul Kulisch und Julius Wortmann vorgeschlagen. J. Schukow erbrachte hierfür in der Forschungsanstalt Geisenheim den Beweis. Jedoch wurde erst viele Jahre später dieser Tatsache Beachtung geschenkt und durch die Arbeiten von Radle in den 1990er Jahren wieder aufgegriffen.[7]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Jancis Robinson: Das Oxford Weinlexikon. 1. Auflage. Gräfe und Unzer Verlag, München 2003, ISBN 3-7742-0914-6.
- Helmut H. Dittrich, Manfred Grossmann: Mikrobiologie des Weines. 3., neu bearb. Auflage. Ulmer Eugen Verlag, Stuttgart 2005, ISBN 3-8001-4470-0.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b T. Zaunmüller u. a.: Variations in the energy metabolism of biotechnologically relevant heterofermentative lactic acid bacteria during growth on sugars and organic acids. In: Appl Microbiol Biotechnol. 72(3), 2006, S. 421–429. PMID 16826375; doi:10.1007/s00253-006-0514-3.
- ↑ S. Kolb u. a.: Energy conservation in malolactic fermentation by Lactobacillus plantarum and Lactobacillus sake. In: Arch Microbiol. 157(5), 1992, S. 457–463. PMID 1510572. doi:10.1007/BF00249105.
- ↑ E. B. Olsen u. a.: Electrogenic L-malate transport by Lactobacillus plantarum: a basis for energy derivation from malolactic fermentation. In: J Bacteriol. 173(19), 1991, S. 6199–6206. PMID 1917854; PMC 208371 (freier Volltext).
- ↑ a b S. Q. Liu: A review: malolactic fermentation in wine - beyond deacidification. In: J Appl Microbiol. 92(4), 2002, S. 589–601. PMID 11966898.
- ↑ A. Koch: Ueber die Ursachen des Verschwindens der Säure bei Gärung und Lagerung des Weines. 1900.
- ↑ Hermann Müller-Thurgau, A. Osterwalder: Die Bakterien im Wein und Obstwein und die dadurch verursachten Veränderungen. In: Centralblatt für Bakteriologie, Parasitenkunde und Infektionskrankheiten. Abt. 2, Band 36, Jena 1913, S. 129–338.
- ↑ L. Alzinger, R. Eder: Einfluss verschiedener Hefepräparate auf die Säurezusammensetzung von Weinen der Sorte Grüner Veltliner. In: Mitt. Klosterneuburg. 53, 2003, S. 52–60.

