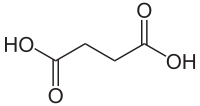
Bernsteinsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bernsteinsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H6O4 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser kristalliner Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 118,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||||||||
| Dichte |
1,56 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
235 °C[3] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
löslich in Wasser (58 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−940,5 kJ/mol[5] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Bernsteinsäure, auch Succinylsäure oder Butandisäure, E 363, ist eine farblose, kristalline aliphatische Dicarbonsäure. Die Kristalle sind in siedendem Wasser gut löslich.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Die Bernsteinsäure wurde 1546 von Georgius Agricola bei der trockenen Destillation durch Erhitzen von Bernstein entdeckt. Nicolas Lémery erkannte als Erster im Jahre 1675 die Säurenatur des Stoffes und Jöns Jakob Berzelius fand die Zusammensetzung (C4H6O4) der Säure heraus. Bis weit in das 20. Jahrhundert waren Arzneimittel auf der Basis von Bernsteinsäure und ihrer Salze zur Anwendung bei Katarrhen und Syphilis in Gebrauch.[6]

Ende des 19. Jahrhunderts versuchte der in Danzig lebende Apotheker Otto Helm die Herkunft von Bernstein anhand seines Gehaltes an Bernsteinsäure zu erkennen. Die auf dem Wege der Trockendestillation gewonnene und in Retorten sublimierte Säure wog Helm und kam zu dem Ergebnis, dass ein Anteil zwischen 3,2 % und 8,2 % auf baltischen Bernstein schließen lasse. Er untersuchte mit dieser Methode auch sizilianischen Bernstein und archäologische Funde unter anderem aus Mykene. Während er in Proben sizilianischen Bernsteins keine Säurespuren fand, wiesen die antiken Stücke einen Säuregehalt von 4,1 % bis 6,3 % auf. Helm hielt damit die seit Alters her Archäologen beschäftigende Frage nach der Herkunft der im Mittelmeerraum gemachten Bernsteinfunde für beantwortet. Es musste sich nach diesen Befunden um baltischen Bernstein handeln.[7] Später stellte sich heraus, dass der Gehalt an Bernsteinsäure kein verlässliches Merkmal zur Identifizierung baltischen Bernsteins ist, da auch in Bernstein anderer europäischer Lagerstätten entsprechende Konzentrationen an Bernsteinsäure gefunden wurden. Helms Herkunftsnachweis behielt indes Gültigkeit, da diese Lagerstätten in der Antike noch nicht bekannt waren.
Rolf C. A. Rottländer kam 1970 zu dem Schluss, Bernsteinsäure sei eigentlich gar nicht von Natur aus in Bernstein enthalten, sondern bilde sich erst im Zuge der alkalischen Hydrolyse des Bernsteins (als ein alkalisches Salz) oder während der Trockendestillation (als sein Anhydrid). Er schlug vor, Bernsteinsäure (als Salz oder Anhydrid) als ein natürliches Oxidationsprodukt von Bernstein und damit als einen Indikator für dessen Alterungsprozess zu betrachten.
Die Frage der Herkunft antiken Bernsteins aus archäologischen Grabungen ist damit weiterhin Gegenstand wissenschaftlicher Diskussionen und wird in jüngerer Zeit mit Hilfe anderer Untersuchungsmethoden (Infrarot-Spektroskopie, Massenspektrometrie, Gaschromatographie, Kernspinresonanzspektroskopie [NMR] und andere mehr) zu beantworten versucht.[8][9][10]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Namensgebend für die Bernsteinsäure ist der Bernstein, ein Schmuckstein aus fossilem Harz, in dem Bernsteinsäure enthalten ist. Traditionell erfolgte die Unterscheidung von verschiedenen Bernsteintypen auf Grund chemischer Substanzen je nach dem Gehalt an Bernsteinsäure in Succinite (3 % bis 8 %) und Retinite (fossile Harze mit einem Gehalt an Bernsteinsäure von weniger als 3 % oder ohne Bernsteinsäure). Auch in vielen Braunkohlen ist Bernsteinsäure enthalten.[11]
Im Stoffwechsel aller Organismen kommt das Salz der Bernsteinsäure beim Abbau von Glucose als Zwischenstufe bei der Regeneration des Akzeptors Oxalessigsäure vor. Es ist entsprechend ein Stoffwechsel-Zwischenprodukt des Citratcyclus, außerdem kommt sie im Harnstoffzyklus vor. In der Natur kommt Bernsteinsäure zudem in vielen Pflanzensäften (Rhabarber, Tomaten)[11] sowie in Algen und Pilzen vor.[12]
Bernsteinsäure kann bei einigen anaerob lebenden Bakterien zudem ein Endprodukt des Stoffwechsels sein, so zum Beispiel im Rinderpansen. Dieser stellt ein System dar, in dem eine Reihe fakultativ anaerob lebender Bakterien ihre Nahrungsgrundlage aus dem Nahrungsbrei beziehen. Von der Pansenflora, vor allem den enthaltenen Pilzen, werden die β-glycosidischen Bindungen der Cellulose in der Nahrung aufgebrochen. Der so entstehende Traubenzucker (Glucose) dient Mikroorganismen als Substrat. Die Produkte des Bakterienstoffwechsels sind vor allem kurzkettige Carbonsäuren wie Essigsäure und Bernsteinsäure sowie Ethanol. Die bakteriell produzierte Bernsteinsäure dient wiederum als Energiequelle für weitere Bakterien, die sie zu Propionsäure umsetzen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Technisch
[Bearbeiten | Quelltext bearbeiten]Technisch sind verschiedene Synthesewege zur Produktion von Bernsteinsäure bekannt. Die Herstellung erfolgt in der Regel über eine katalytische Hydrierung der Maleinsäure, Maleinsäureanhydrid oder Fumarsäure, wobei verschiedene Katalysatoren eingesetzt werden können (Ni, Cu, NiO, CuZnCr, Pd-Al2O3, Pd-CaCO3). Über diesen Syntheseweg werden pro Jahr 20.000 bis 30.000 Tonnen Bernsteinsäure hergestellt.[13]
Außerdem ist die Oxidation von 1,4-Butandiol (BDO) möglich, wobei verschiedene technische Wege existieren. Auch die Hydrocarboxylierung von Acetylenglycol, katalysiert über RhCl3-Pentachlorthiophenol, Acetylen, Acrylsäure, 1,4-Dioxan und Propiolacton ist möglich.[11]
Biotechnologisch
[Bearbeiten | Quelltext bearbeiten]Bernsteinsäure kann durch Fermentation aus Kohlenhydraten hergestellt werden, insbesondere aus Stärke und verschiedenen Oligosacchariden (C6- und C5-Zucker).[14] Hierbei kann das natürliche Vorkommen der Bernsteinsäure im Stoffwechsel genutzt werden, um sie gezielt durch Mikroorganismen herstellen zu lassen. Biotechnologisch hergestellte Bernsteinsäure wird vor allem in Lebensmitteln verwendet,[13] allerdings existieren mittlerweile auch Pilotanlagen zu biotechnologischen Bernsteinsäureproduktion für technische Anwendungen.
Aufgrund der Möglichkeit, biotechnologisch Bernsteinsäure mit Hilfe von Bakterien großtechnisch zu produzieren, wird verstärkt mit Basfia succiniciproducens,[15] Mannheimia succiniciproducens[16] und Anaerobiospirillum succiniciproducens[17] geforscht. Auch der Modellorganismus Escherichia coli, der über Metabolic Engineering für die Produktion hoher Mengen an Bernsteinsäure optimiert werden soll, steht im Fokus der Forschung.[18]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Als Succinate bezeichnet man die Salze und Ester der Bernsteinsäure. Der Begriff 'Succinat' leitet sich vom lateinischen Wort suc(c)inum für Bernstein ab. Succinate enthalten in ihren Kristallgittern das Succinat-Ion als negativ geladenes Anion. Die allgemeine Formel eines Alkalisuccinats lautet MOOC–CH2–CH2–COOM, M steht besonders für Natrium- und Kaliumionen. Alkalisuccinate lösen sich leicht in Wasser. Die Erdalkalisuccinate sind nur schwer, die übrigen Succinate gar nicht wasserlöslich. So findet man Calciumsuccinat in unreifen Früchten oder Algen. Die esterartigen Succinate können durch die Halbstrukturformel R–O–CO–CH2–CH2–CO–O–R beschrieben werden.
Im Jahr 1949 entdeckte Daniel Bovet die muskelerschlaffende Wirkung des Bischolinesters der Bernsteinsäure, des Succinylbischolins, das 1951 als kurzwirksames Muskelrelaxans in die Klinik eingeführt wurde.[19]
Wird Bernsteinsäure erhitzt, spaltet sie Wasser ab und bildet unter Ringschluss das Bernsteinsäureanhydrid.[12]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendung im Lebensmittelbereich
[Bearbeiten | Quelltext bearbeiten]Bernsteinsäure ist in der EU als Lebensmittelzusatzstoff der Nummer E 363 zugelassen und dient aufgrund des mild sauren und zugleich leicht salzigen Geschmacks als Geschmacksverstärker für Desserts, Trockensuppen und Getränkepulver. Als Kochsalzersatz in Diätkost werden verschiedene Salze der Bernsteinsäure genutzt (Fe, Mg, Ca, K).[20] Aufgrund der körpereigenen Produktion und Verstoffwechslung von Bernsteinsäure wird die Verwendung von Bernsteinsäure als Lebensmittelzusatzstoff als unbedenklich angesehen.
Während der alkoholischen Gärung sowie beim späteren Ausbau des Weins in Gebinden wie dem Holzfass oder dem Edelstahlbehälter entstehen neben den zentralen Säuren des Weins (Weinsäure, Äpfelsäure und Citronensäure) auch Bernsteinsäure sowie Essigsäure, Buttersäure und Milchsäure. Bernsteinsäure entsteht dabei vor allem bei der Kohlensäuremaischung und schmeckt leicht bitter und salzig, die Veresterung zu Bernsteinsäuremonomethylester bringt eine mild-fruchtige Komponente in den Wein.
Technische Verwendungen
[Bearbeiten | Quelltext bearbeiten]Bernsteinsäure stellt eine Plattformchemikalie mit einem jährlichen Bedarf von derzeit etwa 15.000 Tonnen und einem Marktwert von sechs bis neun Euro pro Kilogramm dar.[17] Sie wird z. B. zur Herstellung von Polyester- und Alkydharzen verwendet.[20] Einige mit Polyalkoholen veresterte Succinate verwendet man als Lösemittel und Weichmacher für Kunststoffe und Wachse, weitere Ester finden Verwendung in der Parfumherstellung. In Form von Sulfobernsteinsäureestern wird Bernsteinsäure auch als wichtige Tensidgruppe verwendet, diese werden jedoch in der Regel auf der Basis von Maleinsäure hergestellt.
Bernsteinsäure ist zudem einer der zentralen Hoffnungsträger für die Industrielle Biotechnologie als Plattformchemikalie und damit als Rohstoff für verschiedene industriell produzierte Chemikalien und Polymere. Sie kann als Ausgangsstoff für die biotechnologische Produktion bsp. von 1,4-Butandiol (BDO), 1,4-Butandiamin, Tetrahydrofuran (THF), N-Methyl-2-pyrrolidon (NMP), γ-Butyrolactam, γ-Butyrolacton (GBL) und einiger weiterer Produkte dienen.[14] Vor allem als Basis für verschiedene Produkte der chemischen und pharmazeutischen Industrie sowie für biobasierte Kunststoffe wie Polyamide (PA), Polyester und Co-Polyester sowie Polyesteramide ist Bernsteinsäure als biotechnologisch hergestelltes Produkt interessant und es wird ein Marktpotenzial von mehreren hunderttausend Tonnen prognostiziert.[21][17]
Gemeinsam mit weiteren Vertretern der C4-Dicarbonsäuren wie der Fumar- und Äpfelsäure wurde Bernsteinsäure entsprechend durch das Department of Energy der USA im Jahr 2004 als eine von zwölf Plattformchemikalien mit besonderem biotechnologischen Herstellungspotenzial identifiziert.[22] Auch in einer Überarbeitung der Liste von 2010 gehört Bernsteinsäure zu den zehn Produkten der Bioraffinerie-Technologie mit den höchsten Potenzialen.[23]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu SUCCINIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ Eintrag zu E 363: Succinic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 6. August 2020.
- ↑ a b c d e f g h Eintrag zu Bernsteinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-26.
- ↑ K. Andrée: Der Bernstein und seine Bedeutung in Natur- und Geisteswissenschaften, Kunst und Kunstgewerbe, Industrie und Handel. Königsberg 1937.
- ↑ Otto Helm: Mittheilungen über Bernstein. XII. Ueber die Herkunft des in den alten Königs-Gräbern von Mykenae gefundenen Bernsteins und über den Bernsteinsäuregehalt verschiedener fossiler Harze, in: Schriften der Naturforschenden Gesellschaft in Danzig, Band VI, Heft 2, Danzig 1884, S. 234–239.
- ↑ Curt W. Beck: Zur Herkunftsbestimmung von Bernstein. In: Bernstein – Tränen der Götter, Bochum 1996, S. 59–61.
- ↑ George O. Poinar: Life in Amber. Berkeley (USA) 1992.
- ↑ Rolf C. A. Rottländer: "On the formation of amber from Pinus resin", in: Archaeometry 12, 1970, S. 35–51; doi:10.1111/j.1475-4754.1970.tb00004.x; (zitiert bei Poinar 1992).
- ↑ a b c Boy Cornils, Peter Lappe: Dicarboxylic Acids, Aliphatics. In: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a08_523.pub2.
- ↑ a b Artikel Bernsteinsäure in Brockhaus Enzyklopädie online, Bibliographisches Institut & F. A. Brockhaus AG 2005–2009.
- ↑ a b Ana Cukolovic, Christian V. Stevens: Feasibility of production methods for succinic acid: a marriage of renewable resources and chemical technology, in: Biofuels, Bioproducts and Biorefining 2 (6), 2008; S. 505–529; doi:10.1002/bbb.105.
- ↑ a b Todd Werpy, John Frye, John Holladay: Succinic Acid – A Model Building Block for Chemical Production from Renewable Resources. In: Birgit Kamm, Patrisk R. Gruber, Michael Kamm (Hrsg.): Biorefineries - Industrial Processes and Products. Status Quo and Future Directions. Vol. 2. Wiley-VCH Verlag, Weinheim 2006, ISBN 3-527-31027-4, S. 367–379.
- ↑ Edzard Scholten, Torsten Renz, Jochen Thomas: Continuous cultivation approach for fermentative succinic acid production from crude glycerol by Basfia succiniciproducens DD1, in: Biotechnology Letters, 31 (12), 2009, doi:10.1007/s10529-009-0104-4.
- ↑ Sang Yup Lee, Ji Mahn Kim, Hyohak Song, Jeong Wook Lee, Tae Yong Kim, Yu-Sin Jang: From genome sequence to integrated bioprocess for succinic acid production by Mannheimia succiniciproducens, in: Applied Microbiology and Biotechnology, 79 (1), 2008, S. 11–22; doi:10.1007/s00253-008-1424-3.
- ↑ a b c I. Bechthold, K. Bretz, S. Kabasci, R. Kopitzky, A. Springer: Succinic Acid: A New Platform Chemical for Biobased Polymers from Renewable Resources, in: Chemical Engineering & Technology, 31 (5), 2008, S. 647–654; doi:10.1002/ceat.200800063.
- ↑ A. M. Sanchez, G. N. Bennett, K. Y. San: Novel pathway engineering design of the anaerobic central metabolic pathway in Escherichia coli to increase succinate yield and productivity, in: Metabolic Engineering, 3, 2005, S. 229–239; doi:10.1016/j.ymben.2005.03.001.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 23.
- ↑ a b Stichwort Succinic Acid, in: Hans Zoebelein (Hrsg.): Dictionary of Renewable Ressources. 2. Auflage, Wiley-VCH, Weinheim und New York 1996, ISBN 3-527-30114-3, S. 92.
- ↑ James B. McKinley, C. Vieille, J. Gregory Zeikus: Prospects for a bio-based succinate industry, in: Applied Microbiology and Biotechnology, 76 (4), 2007, S. 727–740; doi:10.1007/s00253-007-1057-y.
- ↑ T. Werpy, G. Petersen: Top Value Added Chemicals from Biomass. Volume I — Results of Screening for Potential Candidates from Sugars and Synthesis Gas. Produced by the Staff at Pacific Northwest National Laboratory (PNNL); National Renewable Energy Laboratory (NREL), Office of Biomass Program (EERE), 2004 (PDF).
- ↑ Joseph J. Bozell, Gene R. Petersen: Technology development for the production of biobased products from biorefinery carbohydrates - the US Department of Energy "Top 10" revisited, In: Green Chemistry, 12 (4), 2010, S. 539–554; doi:10.1039/B922014C.

