Caesiumiodid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Cs+ _ I− | |||||||||||||||||||
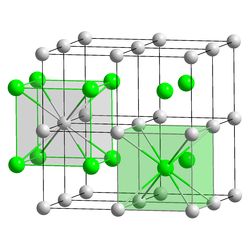
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Pm3m (Nr. 221) | ||||||||||||||||||
| Gitterparameter |
a=4,5679 Å | ||||||||||||||||||
| Koordinationszahlen |
Cs[8], I[8] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caesiumiodid | ||||||||||||||||||
| Andere Namen |
Cäsiumjodid | ||||||||||||||||||
| Verhältnisformel | CsI | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 259,83 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
4,51 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1280 °C[2] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (440 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Brechungsindex |
1,7873[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−347 kJ·mol−1[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Caesiumiodid (auch Cäsiumjodid) ist ein weißes, kristallines Salz mit der Summenformel CsI, das in der IR-, UV- und Röntgenspektroskopie gebraucht wird. Es ist ein Salz der Iodwasserstoffsäure. Das Material ist sehr weich, schwierig zu polieren und empfindlich gegenüber Luftfeuchte. Die maximale Anwendungstemperatur beträgt 200 °C.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Caesiumiodid besitzt einen Brechungsindex von 1,73916 und einen Reflexionsverlust von 13,6 % bei einer Wellenlänge von 10,0 µm. Es ist lichtdurchlässig im Bereich 0,24–70 µm. Die Wärmeleitfähigkeit beträgt 1,13 W/(m · K) und die spezifische Wärmekapazität beträgt 201 J/(kg · K).
Caesiumiodid ist hitzestabil bis etwa 600 °C, die thermische Zersetzung setzt bei 670–800 °C ein.[7]
Die Standardbildungsenthalpie von Caesiumiodid beträgt ΔHf0 = −347 kJ/mol.[6]
Anwendung
[Bearbeiten | Quelltext bearbeiten]
Caesiumiodid kann als transparentes Szintillationsmaterial in Szintillationszählern verwendet werden. Die hochenergetische Strahlung erzeugt im Kristall einen sogenannten elektromagnetischen Schauer, dessen Photonen dann mit einem Photomultiplier in ein messbares elektrisches Signal verwandelt werden. Es kann undotiert oder mit Thallium (Tl) oder Natrium (Na) dotiert als Szintillationsmaterial verwendet werden.
Als undotiertes Material wird es auch in der IR-Spektroskopie als Strahlenteiler verwendet.[8]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- Korth Kristalle GmbH: Cäsiumiodid
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Caesiumiodid bei Alfa Aesar, abgerufen am 16. Februar 2010 (Seite nicht mehr abrufbar).
- ↑ Eintrag zu Caesium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ CRC: Handbook of Chemistry and Physics. 55th edition. CRC-Press, 1974, ISBN 0-87819-454-1.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- ↑ a b Eintrag zu Cäsiumiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1170.
- ↑ I. A. Kulikov, M. L. Malyshev: Radiation-chemical decomposition of CsI. In: Atomic Energy 1983, 55(5), S. 316–318. doi:10.1007/BF01123994
- ↑ E. Riedel: Anorganische Chemie. 8. Auflage, de Gruyter, Berlin 2011, ISBN 9783110225679. S. 624.

