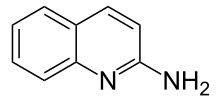
2-Aminochinolin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminochinolin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H8N2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, gelblicher oder grüner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 144,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Methanol oder Chloroform[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2-Aminochinolin ist eine heterocyclische chemische Verbindung, welche aus einem Chinolingerüst besteht, das in 2-Position eine Aminogruppe trägt.
Darstellung
[Bearbeiten | Quelltext bearbeiten]2-Aminochinolin kann durch Aminierung von Chinolin hergestellt werden. Viele nukleophile aromatische Substitutionen laufen an Chinolin, bevorzugt an der elektronenarmen 2-Position des Pyridinrings, ab.[3] Hierzu gehört die Aminierung durch eine Tschitschibabin-Reaktion, bei welcher durch Verwendung von Kaliumamid als Nukleophil in flüssigem Ammoniak bei −66 °C das Amidion bevorzugt an die 2-Position von Chinolin addiert. Durch anschließende Oxidation mit Kaliumpermanganat kann 2-Aminochinolin freigesetzt werden.[4] Hierbei handelt es sich um das kinetische Reaktionsprodukt. Bei Erhöhung der Reaktionstemperatur auf −40 °C findet eine Isomerisierung zum thermodynamisch stabileren 4-substituierten Produkt statt.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 2-Aminoquinoline, >97.0% bei TCI Europe, abgerufen am 28. März 2022.
- ↑ a b c d Datenblatt 2-Aminoquinoline bei Sigma-Aldrich, abgerufen am 23. März 2022 (PDF).
- ↑ J. A. Joules, K. Mills: Heterocyclic Chemistry, 5. Auflage, S. 177–199, Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8.
- ↑ H van der Plas: Oxidative Amino-Dehydrogenation of Azines, in: Adv. Heterocycl. Chem. 2004, 86, 1–40.
- ↑ J. A. Zoltewicz, L. S. Helmick, T. M. Oestreich, R. W. King, P. E. Kandetzki: Addition of amide ion to isoquinoline and quinoline in liquid ammonia. Nuclear magnetic resonance spectra of anionic σ-complexes, in: J. Org. Chem. 1973, 38, 1947–1949; doi:10.1021/jo00950a036.

