Chondroitinsulfat
| Strukturformel | |||
|---|---|---|---|
 Chondroitinsulfat C | |||
| Allgemeines | |||
| Name | Chondroitinsulfat | ||
| Andere Namen |
Poly[(N-acetyl-D-galactosamin-4-O-hydrogensulfat)-(L-iduronsäure)] (IUPAC) | ||
| CAS-Nummer | |||
| Monomere/Teilstrukturen | N-Acetylgalactosamin und Glucuronsäure | ||
| Art des Polymers | |||
| ATC-Code | |||
| Arzneistoffangaben | |||
| Wirkstoffklasse |
Antiarthrotikum | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Chondroitinsulfat (auch Chondritinsulfat) ist ein biologisches Makromolekül. Die von den Chondroblasten gebildete Substanz ist ein wichtiger Bestandteil des Knorpelgewebes und trägt zu dessen Widerstand gegen Kompression bei.[2]
Chemisch handelt es sich um ein Gemisch sulfatierter Glykosaminoglykane (GAG), auch Mucopolysaccharide genannt. In den Polymerketten wechseln sich die Zuckerabkömmlinge N-Acetylgalactosamin (GalNAc) und Glucuronsäure ab.
Chemische Struktur
[Bearbeiten | Quelltext bearbeiten]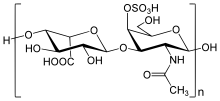
Chondroitinsulfatketten sind unverzweigte Polysaccharide mit variabler Länge. Sie bestehen immer aus zwei sich abwechselnden Einfachzuckern: D-Glucuronsäure (GlcA) und N-Acetylgalactosamin (GalNAc). Hierbei ist die Glucuronsäure mit GalNAc β-1→3 und GalNAc zur Glucuronsäure β-1→4-glykosidisch verknüpft.[3] Eine Chondroitin-Kette kann aus über 100 Zuckereinheiten bestehen, welche unterschiedlich stark und an den Positionen C6 und/oder C4 der GalNAc sulfatiert sein können. Epimerisiert die Glucuronsäure am C5 zur Iduronsäure, spricht man von Dermatansulfaten. Das Verständnis der auffälligen Diversität des Chondroitinsulfats und des verwandten Glykosaminoglykans ist eines der Ziele der Glykobiologie.
Sulfatierung
[Bearbeiten | Quelltext bearbeiten]Jeder Einfachzucker kann entweder ohne, mit einer oder mit zwei Sulfatgruppen vorliegen. Am häufigsten sind die Hydroxygruppen der Kohlenstoffatome 4 und 6 des N-Acetyl-Galactosamins mit einer Sulfatgruppe versehen. Die Sulfatierung wird von verschiedenen Sulfotransferasen katalysiert. Der Sulfatierungsgrad liegt bei durchschnittlich 0,8 bezogen auf das Disaccharid.
Folgende Typen werden unterschieden:
| Chondroitin-Typ | Systematischer Name | Disaccharideinheit | Beschreibung |
|---|---|---|---|
| Chondroitinsulfat A | Chondroitin-4-sulfat | GlcA-GalNAc4S | Sulfatgruppen vorwiegend am Kohlenstoffatom 4 des N-Acetyl-Galactosamins (GalNAc) |
| Chondroitinsulfat B | Dermatansulfat | IdoA2S-GalNAc4S | Sulfatgruppen vorwiegend am Kohlenstoffatom 2 der Iduronsäure und am Kohlenstoffatom 4 des GalNAc |
| Chondroitinsulfat C | Chondroitin-6-sulfat | GlcA-GalNAc6S | Sulfatgruppen vorwiegend am Kohlenstoffatom 6 des GalNAc |
| Chondroitinsulfat D | Chondroitin-2,6-sulfat, Dermatansulfat | GlcA2S-GalNAc6S | Sulfatgruppen vorwiegend am Kohlenstoffatom 2 der Glucuronsäure und am Kohlenstoffatom 6 des GalNAc (Chondroitin-2,6-sulfat) |
| Chondroitinsulfat E | Chondroitin-4,6-sulfat | GlcA-GalNAc4,6diS | Sulfatgruppen vorwiegend am Kohlenstoffatom 4 und 6 des GalNAc |
Die Typisierung durch die Buchstaben A bis E stammt aus der Zeit, als Chondroitinsulfat bereits isoliert wurde, die Struktur aber noch nicht bekannt war.[4] Die Einordnung von Dermatansulfat unter die Chondroitinsulfate als Chondroitinsulfat B wird heute als Fehlbenennung angesehen, da sich diese Verbindung nicht von der Glucuronsäure, sondern von der Iduronsäure ableitet. Die häufigsten Chondroitinsulfate sind die Typen A, B und C.
Die früher gebräuchliche Bezeichnung Chondroitin ohne „Sulfat“, die benutzt wurde, um eine Kette ohne oder mit sehr wenigen Sulfatgruppen zu beschreiben,[5] ist nicht mehr üblich.
Obwohl der Name darauf hindeutet, dass Chondroitinsulfat ein Salz mit einem Sulfat-Anion sei, ist das Sulfat kovalent an den Zucker gebunden. Da das Molekül bei physiologischem pH mehrere negative Ladungen aufweist, liegt es in den Salzen des Chondroitinsulfats als Anion vor. Das handelsübliche Produkt des Chondroitinsulfats ist gewöhnlich dessen Natriumsalz. Barnhill et al. haben vorgeschlagen, dass alle Chondroitinsulfat-Produkte als „Natriumchondroitin“ bezeichnet werden sollten, ohne Rücksicht auf deren Sulfat-Bindungen.[6]
Eine synthetisch nachsulfatierte Variante ist das Chondroitinpolysulfat („übersulfatiertes Chondroitinsulfat“, englisch „oversulfated chondroitin sulfate“, OSCS). Durch die zusätzliche Sulfatierung wird die antientzündliche (antiinflammatorische) Wirkung der Substanz verstärkt. Chondroitinpolysulfat weist zudem eine gerinnungshemmende (antikoagulatorische) und fibrinolytische Aktivität auf.
Proteinbindung
[Bearbeiten | Quelltext bearbeiten]Biologisch liegt Chondroitinsulfat gewöhnlich an Proteine gebunden vor, als Teil eines Proteoglykans. Die Bindung der Chondroitinsulfatketten erfolgt an den die Hydroxygruppen der Serin-Reste bestimmter Proteine. Wie genau die Proteine für die Bindung mit Glykosaminoglykanen ausgewählt werden, ist noch nicht verstanden. Glykosylierten Serinresten folgen häufig Glycinreste, in der Nachbarschaft finden sich saure Aminosäurenreste.
Als Bindeglied der GAG-Kette dient stets dieselbe Zuckerkette aus drei Zuckereinheiten:
| Ser–O–Xyl–Gal–Gal–GlcA-… |
Jeder Zucker wird von einem spezifischen Enzym angebunden, wodurch eine vielschichtige Kontrolle über die GAG-Synthese erlaubt wird. Xylose wird im endoplasmatischen Reticulum an die Proteine gebunden, während der Rest der Zucker im Golgi-Apparat übertragen wird.[7]
Funktion
[Bearbeiten | Quelltext bearbeiten]Die Funktion des Chondroitins hängt stark von den Eigenschaften des gesamten Proteoglykans ab, zu dem es gehört. Chondroitin-Proteoglykane haben sowohl strukturelle als auch regulierende Aufgaben.
Strukturelle Funktion
[Bearbeiten | Quelltext bearbeiten]Chondroitin-Proteoglykane stellen zusammen mit Kollagen wesentliche Bestandteile der extrazellulären Matrix dar. Sie bewirken die strukturelle Integrität des Gewebes. Typische Vertreter sind Aggrecan, Versican, Brevican und Neurocan.
Als Bestandteil von Aggrecan bildet Chondroitinsulfat einen Großteil der Knorpelmasse. Die eng gepackten, stark geladenen Sulfatgruppen führen zu elektrostatischer Abstoßung der einzelnen Ketten (siehe Coulombsches Gesetz), welche einen Großteil des Widerstands der Knorpel gegen Kompression bedingt. Verlust des Chondroitinsulfats aus den Knorpeln ist eine der häufigsten Ursachen für Arthrose.
Regulierende Funktion
[Bearbeiten | Quelltext bearbeiten]Ebenfalls bedingt durch die negativen Ladungen tritt Chondroitinsulfat leicht in Wechselwirkung mit anderen Proteinen der extrazellulären Matrix. Diese Interaktionen sind bedeutend für die Regulation einer Vielzahl zellulärer Vorgänge. Im Vergleich zu Heparansulfat, einem anderen Proteoglycan der extrazellulären Matrix, ist noch wenig über die Rolle von Chondroitinsulfat-Proteoglycanen bekannt. Bekannt ist, dass Chondroitinsulfat Wachstum und Entwicklung des Nervensystems ebenso wie dessen Reaktion auf Verletzung reguliert.
Gewinnung
[Bearbeiten | Quelltext bearbeiten]Chondroitinsulfat wird großenteils aus Knorpelgewebe von Rindern, Schweinen und Haien gewonnen. Auch andere Fischarten und Vögel können Knorpellieferant sein.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Knorpelregeneration, Knorpelschutz
[Bearbeiten | Quelltext bearbeiten]Chondroitinsulfat wird arzneilich und diätetisch verwendet in der Behandlung degenerativer Gelenkerkrankungen (Arthrose) z. B. der Hüfte, des Knies oder der Finger. Ebenso wird Chondroitinsulfat zur Nahrungsergänzung eingenommen um den Knorpel gesund zu erhalten und arthrotischen Verschleißerscheinungen vorzubeugen (Chondroprotektion). Häufig wird es dabei mit Glucosamin kombiniert. Der Anwendung liegt die Vorstellung zugrunde, dass das zugeführte Chondroitinsulfat in den Knorpel „eingebaut“ wird. In vitro (d. h., außerhalb eines lebenden Organismus) weist Chondroitinsulfat eine antiinflammatorische Wirkung auf.
Oral wird Chondroitinsulfat üblicherweise in Dosierungen von 800–1.200 mg pro Tag eingesetzt. Eine Dosis, ab der eine pharmakologische Wirksamkeit eintritt, konnte 2007 vom Bundesinstitut für Risikobewertung aufgrund einer unzureichenden Datenlage nicht abgeleitet werden.[8] Da Chondroitin keine einheitliche Substanz ist und es in der Natur in einem breiten Spektrum verschiedener Formen vorliegt, variiert die Zusammensetzung von Fertigprodukten entsprechend. Es gibt im Bereich der Lebensmittel keine verbindlichen Standards für die Zusammensetzung. In den USA wurde 2000 aufgedeckt, dass ein hoher Anteil chondroitinhaltiger Nahrungsergänzungsmittel mit Bezug auf den Chondroitingehalt falsch oder irreführend etikettiert war.[9]
Zur oralen Bioverfügbarkeit von Chondroitinsulfat und seiner Verstoffwechselung gibt es keine validen Daten.
Wirksamkeit
[Bearbeiten | Quelltext bearbeiten]- In Metaanalysen von 2000 zeigen uneinheitliche Ergebnisse. So kam eine zu dem Schluss, dass es zu einer signifikanten Verbesserung bestimmter Zielparameter (z. B. Lequesne-Index, Visuelle Analogskala) unter einer Arthrosebehandlung mit Chondroitinsulfat kommt.[10] Eine andere sieht bei mittleren und großen Effekten Qualitätsprobleme und einen bezüglich der Wirksamkeit begünstigenden Publikationsbias.[11]
- Das Ergebnis späterer Metastudien (2007[12] & 2010[13]) war, dass Chondroitin, Glucosamin, und deren Kombination keine klinisch relevanten Effekte auf die wahrgenommenen Gelenkschmerzen oder auf den Gelenkverschleiß haben.
- Ein Cochrane-Review von 2015[14] schlussfolgerte, dass Chondroitin bei Kurzzeitstudien (unter 6 Monaten) die Schmerzen insbesondere bei Kniearthritis leicht lindern kann. Zudem erhöht es wahrscheinlich leicht die Lebensqualität (Lequesne-Index). Mehrere Studien wurden von Chondroitin-Herstellern durchgeführt. Außerdem zeigten einigen Studien von besserer methodischer Qualität weder eine Schmerzlinderung noch eine Verbesserung der körperlichen Funktionen.[15]
Generell ist die Studienlage sehr heterogen, was an allgemeinen Verzerrungen (Bias), der unterschiedlichen und geringen Studiengrößen und den in den Studien verwendetem Herstellerprodukt liegt.[16]
Sicherheit
[Bearbeiten | Quelltext bearbeiten]In den üblichen oralen Dosierungen bis 1200 mg pro Tag ist Chondroitinsulfat gut verträglich. Klinische Studien stellten in diesem Dosisbereich keine schwerwiegenden Nebenwirkungen durch Chondroitinsulfat fest.
Die intramuskuläre und intraartikulare Applikationsform von Chondroitinsulfaten ist durch besser verträgliche Hyaluronate verdrängt worden. Ein jahrzehntelang intraartikular als Arthrosemittel angewendetes Chondroitinpolysulfat-Präparat wurde 1992 wegen schwerer anaphylaktischer und thromboembolischer Nebenwirkungen vom Markt genommen.[17]
Augenheilkunde und Urologie
[Bearbeiten | Quelltext bearbeiten]Wässerige Chondroitinsulfatlösungen werden in der Augenheilkunde, in Kombination mit Hyaluronat, während Eingriffen am Auge verwendet, um das Hornhautendothel zu benetzen und zu schützen. Als Blasenspüllösung wird Chondroitinsulfat zur Wiederherstellung der Blasenschleimhaut eingesetzt, etwa wenn diese durch eine chronische Entzündung (interstitielle Zystitis) geschädigt ist.
Lokale antientzündliche Anwendung
[Bearbeiten | Quelltext bearbeiten]Ein Anwendungsgebiet für Chondroitinpolysulfat („übersulfatiertes Chondroitinsulfat“) ist die topische Behandlung stumpfer Verletzungen und oberflächlicher Venenentzündungen (Phlebitiden). In Tierversuchen und an Hautmodellen wurde gezeigt, dass Chondroitinpolysulfat durch die Haut in das darunter liegende Gewebe vorzudringen vermag. Dort soll es seine antientzündliche (antiinflammatorische) Wirkung entfalten. Chondroitinpolysulfat wird als Salbe, Creme oder Gel aufgetragen.
Heparin-Skandal
[Bearbeiten | Quelltext bearbeiten]Im Jahr 2008 kam es weltweit zu dem als „Heparin-Skandal“ bekannten Vorfall, nachdem chinesische Wirkstoffhersteller den Arzneistoff Heparin mit billigerem übersulfatierten Chondroitin (Chondroitinpolysulfat) „gestreckt“ hatten.[18] Infolgedessen waren zahlreiche schwerwiegende Nebenwirkungen aufgetreten, teilweise mit Todesfolge.
Handelspräparate
[Bearbeiten | Quelltext bearbeiten]Chondroitinsulfat
- Monopräparate: Condrosulf (A, CH), Gepan instill (D), Structum (CH)
- Kombinationspräparate mit zusätzlichen Nährstoffen: Glusatin (D, A), Arthrovitan (D), Arthrobel (D), CondroTect (D), Duovital (D), Orthomol Arthro (D), Orthoexpert (D), diverse Nahrungsergänzungsmittel
- Kombinationspräparate mit Hyaluronsäure: ProVisc (D), VisCoat (D), diverse Nahrungsergänzungsmittel
Chondroitinpolysulfat
Hirudoid (D), Kombination mit Salicylsäure: Mobilat DuoAktiv(D)
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- NIH News: Efficacy of Glucosamine and Chondroitin Sulfate May Depend on Level of Osteoarthritis Pain. 22. Februar 2006.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Baeurle SA, Kiselev MG, Makarova ES and Nogovitsin EA: Effect of the counterion behavior on the frictional-compressive properties of chondroitin sulfate solutions. In: Polymer. 50. Jahrgang, 2009, S. 1805–1813, doi:10.1016/j.polymer.2009.01.066.
- ↑ Fotini N. Lamari und Nikos K. Karamanos: Structure of Chondroitin sulfate. S. 34; In: Nicola Volpi (Hrsg.): Chondroitin Sulfate: Structure, Role and Pharmacological Activity (Advances in Pharmacology). Academic Press Inc 2006; ISBN 978-0-12-032955-7
- ↑ P. A. Levene, F. B. La Forge: On Chondroitin Sulphuric Acid. In: Journal of Biological Chemistry. Band 15, Nr. 1, Juli 1913, S. 155–160, doi:10.1016/s0021-9258(18)88551-9.
- ↑ Eugene A. Davidson, Karl Meyer: Chondroitin, a New Mucopolysaccharide. In: Journal of Biological Chemistry. Band 211, Nr. 2, Dezember 1954, S. 605–611, doi:10.1016/s0021-9258(18)71150-2.
- ↑ Barnhill JG, Fye CL, Williams DW, Reda DJ, Harris CL, Clegg DO: Chondroitin product selection for the glucosamine/chondroitin arthritis intervention trial. In: J Am Pharm Assoc. Band 46, Nr. 1, 2006, S. 14–24, PMID 16529337.
- ↑ Silbert JE, Sugumaran G: Biosynthesis of chondroitin/dermatan sulfate. In: IUBMB Life. 54. Jahrgang, Nr. 4, 2002, S. 177–186, PMID 12512856.
- ↑ Bundesinstitut für Risikobewertung: Verwendung von Chondroitinsulfat in Nahrungsergänzungsmitteln, (PDF; 132 kB) Stellungnahme Nr. 031/2007 vom 15. Juni 2007.
- ↑ Adebowale AO Cox DS, Liang Z, Eddington ND: Analysis of glucosamine and chondroitin sulfate content in marketed products and the Caco-2 permeability of chondroitin sulfate raw materials. In: J Am Nutr Assoc. 3. Jahrgang, 2000, S. 37–44 (pettibonsystem.com ( des vom 9. August 2017 im Internet Archive) [abgerufen am 4. April 2018]).
- ↑ B. F. Leeb et al.: A metaanalysis of chondroitin sulfate in the treatment of osteoarthritis. In: The Journal of Rheumatology. Band 27, Nr. 1, Januar 2000, S. 205–211, PMID 10648040 (englisch).
- ↑ T. E. McAlindon et al.: Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. In: JAMA. Band 283, Nr. 11, 15. März 2000, S. 1469–1475, doi:10.1001/jama.283.11.1469, PMID 10732937 (englisch).
- ↑ Stephan Reichenbach et al.: Meta-analysis: chondroitin for osteoarthritis of the knee or hip. In: Annals of Internal Medicine. Band 146, Nr. 8, 17. April 2007, S. 580–590, doi:10.7326/0003-4819-146-8-200704170-00009, PMID 17438317 (englisch).
- ↑ Simon Wandel et al.: Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. In: BMJ (Clinical research ed.). Band 341, 16. September 2010, S. c4675, doi:10.1136/bmj.c4675, PMID 20847017, PMC 2941572 (freier Volltext) – (englisch).
- ↑ Jasvinder A. Singh et al.: Chondroitin for osteoarthritis. In: The Cochrane Database of Systematic Reviews. Band 1, 28. Januar 2015, S. CD005614, doi:10.1002/14651858.CD005614.pub2, PMID 25629804, PMC 4881293 (freier Volltext) – (englisch).
- ↑ Chondroitin bei Arthrose. In: Cochrane Library. 28. Januar 2015, abgerufen am 23. Juli 2022.
- ↑ Germain Honvo et al.: Efficacy of Chondroitin Sulfate in Patients with Knee Osteoarthritis: A Comprehensive Meta-Analysis Exploring Inconsistencies in Randomized, Placebo-Controlled Trials. In: Advances in Therapy. Band 36, Nr. 5, Mai 2019, S. 1085–1099, doi:10.1007/s12325-019-00921-w, PMID 30879253, PMC 6824370 (freier Volltext) – (englisch).
- ↑ arznei-telegramm, 7. Ausgabe, 1992, S. 66 Volltext (PDF; 14 kB).
- ↑ S. Alban: Lehren aus dem Heparin-Skandal, Pharmazeutische Zeitung, Ausgabe 1, 2010.