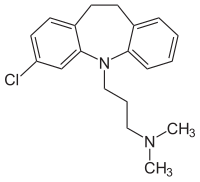
Clomipramin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Clomipramin | |||||||||||||||||||||
| Andere Namen |
3-Chlor-10,11-dihydro-N,N-dimethyl-5H-dibenzo[b,f]azepin-5-propanamin (IUPAC) | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| pKS-Wert |
6,7[4] | |||||||||||||||||||||
| Löslichkeit |
Wasser: 0,29 mg·l−1 (25 °C) (Base)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Clomipramin ist eine chemische Verbindung aus der Gruppe der Dibenzazepine. Pharmakologisch ist es der Gruppe der trizyklischen Antidepressiva zuzurechnen. Es wird fast ausschließlich in Form des besser wasserlöslichen Hydrochlorids eingesetzt.[8] Clomipramin ist ein Derivat von Imipramin, einem anderen trizyklischen Antidepressivum. Es unterscheidet sich von diesem nur durch einen zusätzlichen Chlor-Substituenten.
Clomipramin dient bis heute als Vergleichsstandard bei der Entwicklung von neuen Psychopharmaka zur Behandlung der Zwangsstörung. Wegen seiner hohen Wirksamkeit wurde Clomipramin als einziges Medikament in die WHO-Liste der unentbehrlichen Arzneimittel in der Kategorie obsessive compulsive disorders („Zwangsstörungen“) aufgenommen.[9]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Clomipramin wurde in den 1960er Jahren vom Schweizer Pharmaunternehmen Geigy (heute Novartis) entwickelt.[8] In Deutschland wird es bis heute unverändert unter dem Handelsnamen Anafranil von Dolorgiet (Bad Godesberg) vertrieben; inzwischen ist es als Generikum von zahlreichen Herstellern verfügbar.
Wirkweise
[Bearbeiten | Quelltext bearbeiten]Clomipramin wirkt vorwiegend antriebssteigernd und stimmungsaufhellend. Die stimmungsaufhellende Wirkung des Clomipramin setzt in ca. 1–2 Wochen, die antiobsessive (Wirkung gegen Zwangssymptome) etwas später ein.
Es zeichnet sich durch ein duales Wirkprinzip aus – nämlich Serotonin- und Noradrenalin-Wiederaufnahme-Hemmung, begleitet von α1-Adrenorezeptoren-Blockade. Die Down-Regulation der β-Adrenorezeptoren gehört zu den therapeutischen Effekten. Im lysosomalen Lipidstoffwechsel hemmt Clomipramin außerdem die saure Sphingomyelinase und gehört somit zur pharmakologischen Gruppe der FIASMAs.[10]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Clomipramin ist bei der Behandlung von Zwangsstörungen deutlich wirksamer als die SSRI.[11] Es besitzt ein breites therapeutisches Spektrum: So wird es in der Therapie von schweren, behandlungsresistenten und chronischen Depressionen sowie Angstzuständen (z. B. Agoraphobie) häufig verwendet und zwar mit einem gut dokumentierten Erfolg.
Der Wirkstoff wird außerdem zur Behandlung der Kataplexie eingesetzt, einem der vier Leitsymptome der Schlafstörung Narkolepsie.[12][13]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Eine zweistufige Synthese geht vom 3-Chlor-10,11-dihydro-5H-dibenzo[b,f]azepin aus, welches zunächst mit Natriumamid deprotoniert und dann mit 3-Dimethylaminopropylchlorid umgesetzt wird.[7]

Bei einer weiteren dreistufigen Synthese wird die Dibenzazepinausgangverbindung zunächst mittels Phosgen in eine Carbamoylchloridzwischenverbindung überführt. Im zweiten Schritt entsteht mit 3-Dimethylamino-1-propanol ein Carbamatzwischenprodukt, welches dann bei Temperaturen zwischen 160 °C und 210 °C decarboxyliert wird.[7]

Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Clomipraminhydrochlorid tritt in drei polymorphen Formen auf. Die Schmelzpunkte betragen für das Polymorph I 194 °C, für das Polymorph II 189 °C und für das Polymorph III 179 °C. Bei Polymorph I handelt es sich um die thermodynamisch stabile Form. Die beiden anderen Polymorphe sind metastabil und stehen monotrop zu Polymorph I.[1]
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Die Nebenwirkungen entsprechen denen der Substanzgruppe der trizyklischen Antidepressiva, insbesondere anticholinerge Wirkungen.
Unklar ist die Mutagenität, in Tierversuchen bei der Fruchtfliege Drosophila zeigte sich eine mutagene Wirkung, d. h., es kam zu Veränderungen des Erbguts. Es ist unklar, was das für den Menschen bedeutet.[14]
Schwangerschaft
[Bearbeiten | Quelltext bearbeiten]Es gibt klare Hinweise für Risiken des menschlichen Fötus bei Einnahme während der Schwangerschaft, aber der therapeutische Nutzen für die Mutter kann überwiegen. Die Anwendung von Clomipramin während der Schwangerschaft ist nur bei zwingender Indikation in Betracht zu ziehen, wenn keine Alternative mit geringerem Risiko existiert.[14]
In Tierstudien wurden keine teratogenen Wirkungen beobachtet. Jedoch kann Clomipramin bei pränataler Verabreichung und bei Gabe während der Stillphase Verhaltensstörungen bei den Nachkommen der Muttertiere auslösen.[15]
Fahrtüchtigkeit
[Bearbeiten | Quelltext bearbeiten]Es können verschwommenes Sehen, Benommenheit und andere Symptome des Zentralnervensystems auftreten, die das Autofahren und das Bedienen von Maschinen beeinflussen können.[14]
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Grapefruitsaft kann durch Enzymhemmung den Abbau von Clomipramin in der Leber reduzieren und so die Bioverfügbarkeit des Psychopharmakons um etwa das Vierfache steigern.[16]
Neonatal Clomipramin
[Bearbeiten | Quelltext bearbeiten]Seit 1982 haben Wissenschaftler die Technik Neonatal Clomipramine verwendet, um Tiere aufzuziehen, die in der Depressionsforschung benutzt werden. Wenn 8–21 Tage alte Ratten Clomipramin erhalten, entwickeln sie als Erwachsene einen Zustand, welcher der Depression bei Menschen ähnelt.[17][18]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Anafranil (D, A, CH), verschiedene Generika[19][20][21]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Markus Gastpar (Hrsg.): Clomipramin. Bilanz und Perspektive. 13 Tabellen. Thieme, Stuttgart / New York 1996, ISBN 3-13-104261-3.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Clomipramin bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d M. Kuhnert-Brandstätter, L. Linsmayer, G. Kramer: Thermoanalytische Untersuchungen psychotroper Substanzen vom Typ der Abwandlungsprodukte des Phenothiazins und der Butyrophenone auf Isomorphie und Polymorphie. I. In: Microchim Acta. 83, 1984, S. 103–119, doi:10.1007/BF01237265.
- ↑ P. N. Craig, B. M. Lester, A. J. Saggiomo, C. Kaiser, C. L. Zirkle: Analogs of Phenothiazines. I. 5H-Dibenz[b,f]azepine and Derivatives. A New Isostere of Phenothiazine. In: J. Org. Chem. 26, 1961, S. 135–138, doi:10.1021/jo01060a032.
- ↑ Patent CH371799 (1958) Geigy AG.
- ↑ I. Zahradnik, I. Minarovic, A. Zahradnikova: J. Pharm. Exp. Therap. 324, 2008, S. 977–984.
- ↑ Eintrag zu Clomipramine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Clomipramine hydrochloride bei Sigma-Aldrich, abgerufen am 23. März 2011 (PDF).
- ↑ a b c d e f g h i j k A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2.
- ↑ a b Eintrag zu Clomipramin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juli 2011.
- ↑ WHO Model List of Essential Medicines. (PDF, 431 kB). 17th list, März 2011.
- ↑ J. Kornhuber, M. Muehlbacher, S. Trapp, S. Pechmann, A. Friedl, M. Reichel, C. Mühle, L. Terfloth, T. Groemer, G. Spitzer, K. Liedl, E. Gulbins, P. Tripal: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. Band 6, Nr. 8, 2011, S. e23852, doi:10.1371/journal.pone.0023852.
- ↑ D. A. Geller, J. Biederman, S. E. Stewart, B. Mullin, A. Martin, T. Spencer, S. V. Faraone: Which SSRI? A meta-analysis of pharmacotherapy trials in pediatric obsessive-compulsive disorder. In: The American Journal of Psychiatry, 160, Nr. 11, 2003, S. 1919–1928. PMID 14594734. doi:10.1176/appi.ajp.160.11.1919.
- ↑ S3-Leitlinie Nicht erholsamer Schlaf/Schlafstörungen der Deutschen Gesellschaft für Schlafforschung und Schlafmedizin (DGSM). In: AWMF online (Stand 2009)
- ↑ M. Schachter, J. D. Parkes: Fluvoxamine and clomipramine in the treatment of cataplexy. In: J Neurol Neurosurg Psychiatry, 43, Nr. 2, Februar 1980, S. 171–174. PMID 6766990, PMC 490494 (freier Volltext).
- ↑ a b c Fachinformation aus dem Arzneimittel-Kompendium der Schweiz für Anafranil von Novartis Pharma Schweiz – Stand: Mai 2009.
- ↑ Deutsche Fachinformation: Anafranil; Stand: Mai 2007.
- ↑ Patrick Terheyden, Angela Krackhardt, Thomas Eigentler: Systemtherapie des Melanoms. Einsatz von Immuncheckpoint-Inhibitoren und Hemmung von intrazellulärer Signaltransduktion. In: Deutsches Ärzteblatt, Band 116, Heft 29 f., (22. Juli) 2019, S. 497–504, hier: S. 511.
- ↑ G. Vogel, D. Neill, M. Hagler, D. Kors: A new animal model of endogenous depression: a summary of present findings. In: Neurosci Biobehav Rev. Band 14, Nr. 1, 1990, S. 85–91, PMID 2183099.
- ↑ J. Velazquez-Moctezuma, A. Aguilar-Garcia, O. Diaz-Ruiz: Behavioral effects of neonatal treatment with clomipramine, scopolamine, and idazoxan in male rats. In: Pharmacol. Biochem. Behav. Band 46, Nr. 1, September 1993, S. 215–217, PMID 7902983.
- ↑ Rote Liste online, Stand: Juni 2010.
- ↑ AM-Komp. d. Schweiz, Stand: Juni 2010.
- ↑ AGES-PharmMed, Stand: Juni 2010.