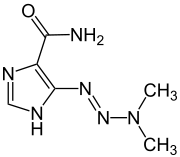
Dacarbazin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dacarbazin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H10N6O | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses oder schwach gelbliches Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 182,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
4,4[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Dacarbazin ist ein Zytostatikum aus der Gruppe der Alkylantien. Es wird als Einzelsubstanz oder im Rahmen von Kombinationsschemata mit weiteren Stoffen beim malignen Melanom, dem Weichteilsarkom (EDIC-Schema) und dem Hodgkin-Lymphom (ABVD-Schema) eingesetzt. Es ist in der WHO-Liste der unverzichtbaren Arzneimittel aufgeführt.
Dacarbazin ist als lösliches Pulver im Handel. Die Lösung ist lichtempfindlich und muss mit einem lichtundurchlässigen Infusionssystem intravenös verabreicht werden.
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Die Gabe von Dacarbazin kann mit gravierenden Nebenwirkungen einhergehen und wird in der Regel nur von einem Onkologen durchgeführt. Sehr häufig (> 90 %) kommt es zu Appetitlosigkeit, Übelkeit und Erbrechen, weshalb es in Kombination mit Antiemetika gegeben wird. Häufig kommt es zu Störungen der Blutbildung (Anämie, Leukopenie, Thrombozytopenie, selten einer Panzytopenie), weshalb Blutbild-Kontrollen durchgeführt werden müssen. Aufgrund möglicher (seltenen) Nekrosen der Leber muss auch die Funktion derselben kontrolliert werden. Es kann weiterhin in seltenen Fällen zu Störungen der Nierenfunktion, allergischen Reaktionen, Kopfschmerzen, Sehstörungen, Verwirrtheit, Lethargie, Krämpfen, Parästhesien, Durchfall, Haarausfall, Erythemen oder Hyperpigmentierung der Haut sowie grippeartigen Beschwerden kommen.
Bei versehentlicher paravenöser Injektion muss mit lokalen Schmerzen und Nekrosen gerechnet werden.
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Gegenanzeigen sind Schwangerschaft, Stillzeit, Leukopenie und/oder Thrombozytopenie sowie schwerwiegende Leber- oder Nierenerkrankungen.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Pharmakodynamik
[Bearbeiten | Quelltext bearbeiten]Die antineoplastische Wirkung bewirkt Dacarbazin durch eine (Zellzyklus-unabhängige) Hemmung des Zellwachstums. Dies geschieht durch Hemmung der DNA-Synthese durch einen alkylierenden Effekt (vgl. Alkylantien).
Dacarbazin ist ein Prodrug, das in der Leber von Cytochrom P450 durch N-Demethylierung zu 5-Aminoimidazol-4-carboxamid und einem Methylkation metabolisiert wird, dem die zytostatischen Effekte zugeschrieben werden.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Dacarbazin diffundiert nach intravenöser Gabe schnell in die Gewebe, die Verteilungshalbwertszeit beträgt etwa 20 Minuten. Die Plasmahalbwertszeit liegt bei 0,5–3,5 Stunden. Der Abbau geschieht über mehrere Metaboliten über das Cytochrom-P450-System der Leber, etwa ein Drittel wird unverändert über die Nieren ausgeschieden.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate: Dacin (CH), Dacarbazin-LIPOMED (D), Detimedac (D)
Literatur
[Bearbeiten | Quelltext bearbeiten]- Fachinformation Dacarbazin (Detimedac), Stand Juli 2006
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Dacarbazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. August 2016.
- ↑ a b c Datenblatt Dacarbazine bei Sigma-Aldrich, abgerufen am 23. Januar 2024 (PDF).
- ATC-L01
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Gesundheitsschädlicher Stoff bei Einatmen
- Hautreizender Stoff
- Augenreizender Stoff
- Atemwegsreizender Stoff
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Arzneistoff
- Zytostatikum
- Imidazol
- Azoverbindung
- Aromatisches Carbonsäureamid
- Dimethylamin