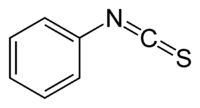
Phenylisothiocyanat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phenylisothiocyanat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H5NS | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche, tränenreizende Flüssigkeit von beißendem, senfartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 135,19 g·mol−1 | ||||||||||||||||||
| Dichte |
1,13 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt |
−21 °C[2] | ||||||||||||||||||
| Siedepunkt |
218 – 221 °C[2] | ||||||||||||||||||
| Dampfdruck |
10 hPa (20 °C)[2] | ||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,6492 (23 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Phenylisothiocyanat (PITC) ist eine chemische Verbindung, die als Reagenz für die chemische Analytik (Edman-Reagenz) und die organische Synthesechemie verwendet wird. Der andere Name Phenylsenföl ist auf die Verwandtschaft mit dem Geschmacksträger des Senfs, dem Allylisothiocyanat (CH2=CH–CH2N=C=S), zurückzuführen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Neben dem Hauptbestandteil Allylisothiocyanat enthält das Senföl des Braunen Senfs auch Phenylisothiocyanat.[4]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Anilin reagiert mit Kohlenstoffdisulfid in Ethanol und fein verteiltem Kaliumhydroxid als Katalysator zu Diphenylthioharnstoff. Diese Reaktion verläuft vermutlich über die Zwischenprodukte Phenyldithiocarbaminsäure und Phenylisothiocyanat unter Abspaltung von Schwefelwasserstoff. Aus dem gebildeten Diphenylthioharnstoff wird im nächsten Schritt bei der Einwirkung von Säuren unter Abspaltung von Anilin Phenylisothiocyanat gebildet:[5]
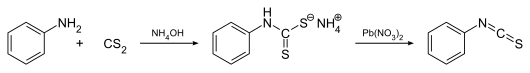
Eine weitere Methode zur Darstellung von Phenylisothiocyanat geht ebenfalls von Anilin und Kohlenstoffdisulfid in konzentrierter Ammoniak-Lösung aus. Das als Zwischenprodukt isolierte Salz Ammoniumphenyldithiocarbamat wird mit Bleinitrat in Phenylisothiocyanat überführt:[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Phenylisothiocyanat ist eine farblose bis gelbliche Flüssigkeit von beißendem, senfartigem Geruch, die die Augen zu Tränen reizt.[1] Bei Normaldruck siedet die Verbindung bei 221 °C.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend
im Temperaturbereich von 320 K bis 491 K.[7]
Die Verbindung reagiert heftig mit Alkoholen, Aminen, Säuren, Basen, Wasser und Oxidationsmitteln.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Es wird als Laufmittel in der Umkehrphasen-Hochleistungsflüssigkeitschromatographie zur Analyse von sekundären Aminen eingesetzt und in der Synthesechemie als Reagenz im Edman-Abbau verwendet und daher „Edman-Reagenz“ genannt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Phenylisocyanat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- ↑ a b c d e f g h i Eintrag zu Phenylisothiocyanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-428.
- ↑ Zi-Tao Jiang, Rong Li, Yu-Min Zuo: Composition of Essential Oil of Brassica juncea (L.) Coss. from China. In: Journal of Essential Oil Research. Band 11, Nr. 4, Juli 1999, S. 503–506, doi:10.1080/10412905.1999.9701196.
- ↑ L. F. Fieser, M. Fieser: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, 1957, S. 703.
- ↑ F. B. Dains, R. Q. Brewster, C. P. Olander: Phenyl isothiocyanate In: Organic Syntheses. 6, 1926, S. 72, doi:10.15227/orgsyn.006.0072; Coll. Vol. 1, 1941, S. 447 (PDF).
- ↑ D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. Band 39, 1947, S. 517–540., doi:10.1021/ie50448a022