Emissionsspektrum


Ein Emissionsspektrum ist das elektromagnetische Spektrum, das von Atomen, Molekülen oder Materialien ausgestrahlt wird, ohne dass elektromagnetische Strahlung gleicher Frequenz eingestrahlt wird. Das Gegenstück eines Emissionsspektrums bildet das Absorptionsspektrum. Während diskrete Energieniveaus ein Linienspektrum hervorrufen, rufen Energiebänder ein kontinuierliches Spektrum hervor.
Das Emissionsspektrum besteht aus einzelnen Emissionslinien oder Emissionsbanden die von einem Medium bei hohen Temperaturen, direkter elektrischer oder chemischer Anregung ausgesandt werden. Emissionsspektren wie auch Absorptionsspektren werden in der Spektroskopie und speziell in der Atomspektroskopie zur qualitativen und quantitativen Analyse genutzt.[1]
Atomspektrum
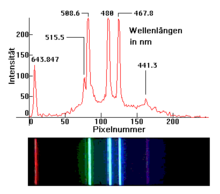
[Bearbeiten | Quelltext bearbeiten]Ein Atomspektrum ist das Emissionsspektrum eines einzelnen isolierten Atoms, also die Intensität des von ihm ausgesandten (emittierten) Lichts als Funktion der Wellenlänge (oder Frequenz). Die einzelnen Spektrallinien des Spektrums entsprechen dabei jeweils der Energiedifferenz zwischen zwei verschiedenen Zuständen des Atoms, die beispielsweise durch ein absorbiertes Lichtteilchen (Photon) aufgebracht und anschließend in Form eines anderen Photons, mit jener Energie, wieder abgegeben, also emittiert werden kann. Diese Energiedifferenz (oder im Spektrum die Linie) ist diskret, kann also nicht beliebige Werte annehmen, so dass jedes Atom – entsprechend seiner spezifischen Elektronenkonfiguration – nur Photonen ganz bestimmter, diskreter Wellenlängen emittieren kann, die dabei charakteristisch für die einzelnen chemischen Elemente sind.
Dass die „Linien“ im Spektrum (‚peaks‘) dabei exakterweise Kurven mit einer bestimmten Breite sind, beruht dagegen auf Quanteneffekten. So zeigt ein Vergleich der beiden oberen Bilder (1, 2), dass die Spektral„linien“ mit steigendem Gasdruck breiter werden und die Breite dieser „Linien“ bei sehr hohem Druck so weit ansteigen kann, dass man praktisch ein Lichtkontinuum ähnlich dem eines strahlenden Festkörpers beobachtet. Ursache dieses Effekts ist die mit steigendem Druck zunehmende Häufigkeit gegenseitiger Störungen der Atome bei ihrem Zusammenprall. Am Beispiel der Spektrallinie bei 491,6 nm ist gut zu erkennen, wie stark die relative Intensität dieser Linie vom jeweiligen Gasdruck abhängt.
Im unteren Bild (3) erkennt man eine andere Charakteristik der Spektrallinien für das Element Cadmium.
Wird durch Absorption eines Photons ein Elektron gänzlich von seinem Atom gelöst, spricht man von einer Ionisierung dieses Atoms, für die, abhängig vom Ausgangszustand des Elektrons, eine bestimmte Mindestenergie notwendig ist. Energiezufuhren über diese Mindestenergie hinaus führen damit stets zu einer Ionisierung, was erklärt, weshalb in diesem Energiebereich dann auch, abweichend vom bisher Gesagten, Kontinua möglich sind. Den umgekehrten Vorgang, d. h. die Emission eines Photons beim Einfangen eines Elektrons durch ein positives Ion, nennt man Rekombination, bei der ebenfalls, wie gerade erläutert, eine kontinuierliche Strahlung entstehen kann, das sogen. Grenzkontinuum.
Molekülspektrum
[Bearbeiten | Quelltext bearbeiten]Ein Molekülspektrum ist im Ergebnis eines Spektrums dem beschriebenen Atomspektrum gleich. Allerdings sind die Energieniveaus zumeist anders und so liegen die relevanten Linien im Infraroten.
Emissionsspektrum eines festen oder flüssigen Materials
[Bearbeiten | Quelltext bearbeiten]Während das Emissionsspektrum verdünnter Gase ein Linienspektrum ergibt, emittieren heiße Festkörper und Flüssigkeiten ein kontinuierliches Spektrum, weil die einzelnen Atome zusätzlich miteinander wechselwirken und somit die diskreten Quantenzustände ineinander übergehen. Solch ein kontinuierliches Spektrum lässt sich berechnen, indem man das Spektrum eines Schwarzen Strahlers (Plancksches Strahlungsgesetz) gleicher Temperatur mit dem Absorptionskoeffizienten für elektromagnetische Strahlung des „Objekts“ bei der jeweiligen Wellenlänge multipliziert.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Emissions- und Absorptionsspektrum auf Schülerniveau (LEIFI)
- Video: Absorptions- und Emissionsspektrum von Natrium. Institut für den Wissenschaftlichen Film (IWF) 2004, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-14885.
- Atomspektrum. In: Ulrich Kilian u. Christine Weber (Hrsg.): Lexikon der Physik. Spektrum Akademischer Verlag, 2003, ISBN 978-3-86025-296-3 (spektrum.de).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Emiisionsspektrum. In: Ulrich Kilian u. Christine Weber (Hrsg.): Lexikon der Physik. Spektrum Akademischer Verlag, 2003, ISBN 978-3-86025-296-3 (spektrum.de).