Fc-Rezeptoren
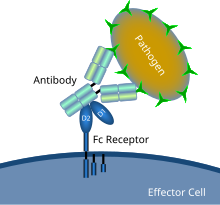
Fc-Rezeptoren sind Membranrezeptoren für verschiedene Immunglobulinisotypen. Alle Moleküle außer dem FcRn-Rezeptor gehören zur Immunglobulin-Superfamilie. Der Name beruht auf der Bindungsspezifität der Rezeptoren zu einem Teil am C-Terminus eines Antikörpers welcher Fc-Fragment (engl. fragment crystallisable) genannt wird und der konstanten Region eines Antikörpers.[1] Fc-Rezeptoren sind glykosyliert.[2] Er wird vor allem von myeloiden Zellen des Immunsystems gebildet.[3] Nach ihrer Proteinstruktur können sie in zwei Gruppen eingeteilt werden.[4] Nach ihrer Affinität werden sie in fünf Subtypen eingeteilt, die entsprechend ihrem gebundenen Immunglobulin bezeichnet werden.
Typen
[Bearbeiten | Quelltext bearbeiten]Fcα-Rezeptor (synonym CD89) bindet die Fc-Domäne von IgA. Der Rezeptor ist auf der Oberfläche von Monozyten, Makrophagen, neutrophilen und eosinophilen Zellen zu finden.
Die Fcγ-Rezeptoren binden die Fc-Domäne von IgG. Sie sind auf der Oberfläche von Phagozyten, B-Lymphozyten, NK-Zellen und dendritischen Zellen zu finden. Diese Rezeptoren können aggregierte IgG-Moleküle erkennen und diese binden. Die Bindung löst je nach Zelltyp unterschiedliche Reaktionen aus: z. B. Opsonisierung oder ADCC (durch NK-Zellen). Es gibt verschiedene Strukturtypen des Fcγ-Rezeptors (FcγRI oder CD64, FcγRII oder CD32 und FcγRIII oder CD16).
Die Fcε-Rezeptoren binden die Fc-Domäne von freiem IgE. Sie sind auf der Oberfläche von Mastzellen und basophilen Granulozyten zu finden. Durch Bindung von Antigenen an diese gebundenen Antikörper kommt es zu einer Aktivierung der Mastzelle. Dieser Vorgang spielt bei der Typ-I-Allergie eine entscheidende Rolle. Es werden in Säugetieren zwei Typen von Fcε-Rezeptoren unterschieden, FcεRI mit hoher Affinität und FcεRII mit niedriger Affinität zu IgE.
Fcμ-Rezeptoren binden die Fc-Domäne von IgM.
Der neonatale Fcγ-Rezeptor (FcRn) gehört zur MHC-Superfamilie und bindet IgG mit schwacher Affinität.
TRIM21 bindet Fc-Regionen von IgG, IgA und IgM im Zuge eines intrazellulären Antikörper-vermittelten Abbaus. Bakterielle Fc-bindende Proteine sind Protein A und Protein G.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Marc Daëron: Fc Receptors. Springer, 2014, ISBN 978-3-319-07911-0. S. 4.
- ↑ J. M. Hayes, E. F. Cosgrave, W. B. Struwe, M. Wormald, G. P. Davey, R. Jefferis, P. M. Rudd: Glycosylation and Fc receptors. In: Current topics in microbiology and immunology. Band 382, 2014, S. 165–199, doi:10.1007/978-3-319-07911-0_8, PMID 25116100.
- ↑ J. M. Hayes, E. F. Cosgrave, W. B. Struwe, M. Wormald, G. P. Davey, R. Jefferis, P. M. Rudd: Glycosylation and Fc receptors. In: Current topics in microbiology and immunology. Band 382, 2014, S. 165–199, doi:10.1007/978-3-319-07911-0_8, PMID 25116100.
- ↑ A. Pincetic, S. Bournazos, D. J. DiLillo, J. Maamary, T. T. Wang, R. Dahan, B. M. Fiebiger, J. V. Ravetch: Type I and type II Fc receptors regulate innate and adaptive immunity. In: Nature Immunology. Band 15, Nummer 8, August 2014, S. 707–716, doi:10.1038/ni.2939, PMID 25045879.