Gadotersäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
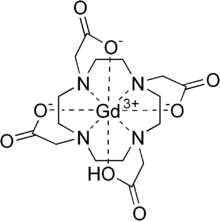
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Gadotersäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C16H25GdN4O8 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse |
Paramagnetisches Kontrastmittel | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 558,7 g·mol−1 als Gd-DOTA | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gadotersäure, oft auch als Gd-DOTA bezeichnet, ist der internationale Freiname für ein diagnostisch genutztes Kontrastmittel, das in der Magnetresonanztomografie (MRT) verwendet wird.
Aufbau und Wirkprinzip des Kontrastmittels
[Bearbeiten | Quelltext bearbeiten]Ein Molekül Gadotersäure enthält ein Gadolinium-Ion, das mit Hilfe des starken Komplexbildners 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure (DOTA) in komplexierter Form vorliegt. Die Komplexierung ist sehr wichtig, da freie, nicht komplexierte Gadolinium-Ionen für den menschlichen und die meisten tierischen Organismen toxisch sind. Die Komplexbildungskonstante von DOTA liegt bei einem pH-Wert von 7 oberhalb von 1020. Gadotersäure ist der stabilste zugelassene Gadolinium-Komplex mit der längsten Dissoziationshalbwertszeit.[2][3]
Gadolinium hat auf der äußeren Elektronenschale (f-Schale) sieben ungepaarte Elektronen, die dem Element einen starken Paramagnetismus verleihen. Protonen, wie sie etwa im Wasser von Körperflüssigkeiten vorkommen, relaxieren in der Nähe zu Gadolinium deutlich rascher. Insbesondere die sogenannte T1-Zeit wird durch das Gadolinium erheblich verkürzt. Bereiche, in denen sich das Kontrastmittel anreichert, werden daher in T1-gewichteten Bildern heller dargestellt als andere Strukturen. Dadurch wird die Bildqualität einer MRT-Aufnahme erheblich verbessert und der Kontrast zwischen Pathologien und dem umliegenden normalen Gewebe erhöht.
Gadotersäure ist ein unspezifisches Kontrastmittel, das sich in allen Organen außerhalb des Zentralnervensystems anreichert. In der initialen Perfusionsphase breitet sich die Gadotersäure im Intravasalraum aus und tritt dann rasch in den Extrazellularraum. Der glomerulären Filtrationsrate (GFR) entsprechend wird es renal, das heißt über die Niere unverändert (keine Metabolisierung, keine Dissoziation und keine Retention) ausgeschieden. Dadurch, dass sich Gd-DOTA im Extrazellularraum sämtlicher extra-zerebraler Gewebe nicht-selektiv verteilt, kann es nicht organspezifisch eingesetzt werden.[4] Wegen seiner Hydrophilie kann Gd-DOTA intakte Zellmembranen nicht passieren. Daher ist es nach intravenöser Applikation nur im intravasalen Raum und im Interstitium zu finden. Wegen der sehr geringen Proteinbindung wird es relativ rasch über die Niere ausgeschieden.[5]
Gadotersäure wurde erstmals 1989 in einigen europäischen Ländern als zweites MRT-Kontrastmittel (nach Gadopentetat-Dimeglumin (Gd-DTPA)) zugelassen. Als hochpolares und relativ großes Molekül ist Gadotersäure bei einem gesunden Menschen nicht in der Lage, die Blut-Hirn-Schranke zu überwinden. Bei einigen Erkrankungen, wie beispielsweise bei einem Glioblastom, kann es jedoch die geschädigte Blut-Hirn-Schranke überwinden und in das erkrankte Gewebe eindringen. Somit ist es möglich, genauere Informationen über die Art und Lage des Tumors zu gewinnen. Auch grenzt sich der Tumor in der Bildgebung besser gegenüber dem gesunden Gewebe ab. Die Überwindung der Blut-Hirn-Schranke gilt als wichtiges Diagnosekriterium für Gehirntumore.
Im menschlichen Organismus beträgt die Verteilungshalbwertszeit etwa 2 bis 3 Minuten, während die Plasmahalbwertszeit etwa 90 Minuten beträgt. Der mittlere hydrodynamische Durchmesser beträgt ungefähr 5 nm.[4] Der Moleküldurchmesser beträgt ca. 0,9 nm.[6]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Gadotersäure ist sehr gut verträglich. Gelegentlich (bei 0,1 – 1 Prozent der Behandelten) kommt es zu Überempfindlichkeitsreaktionen. Allergische Reaktionen sind häufiger bei Patienten mit bekannter Unverträglichkeit auf Kontrastmittel (auch iodhaltige), Asthma unter Behandlung oder auch Patienten mit mehreren Allergien. Wie bei allen gadoliniumhaltigen Kontrastmitteln kann es zu Übelkeit, Erbrechen, Hautausschlägen, Zittern, Dyspnoe, Bronchospasmus, Kopfschmerzen, metallischem Geschmack oder auch Hitze beim Injizieren kommen. Bei höheren Dosen und vorbestehender Niereninsuffizienz oder Nierenerkrankungen kann es in seltenen Fällen zu einer kontrastmittelinduzierten akuten Niereninsuffizienz kommen. Diese tritt meist verzögert nach 48 bis 72 Stunden auf und ist meist reversibel. Wegen der hohen Osmolalität der Lösung von 1300 mOsm/kg Wasser, und der damit verbundenen Gefahr hoher lokaler Konzentrationen, ist die unbeabsichtigte extravaskuläre Injektion unbedingt zu vermeiden. Im Gegensatz zu anderen auf Gadolinium basierenden Kontrastmitteln wurde bisher bei keinem der über 25 Millionen behandelten Patienten eine durch Gadotersäure verursachte nephrogene systemische Fibrose beobachtet.[7][8][9]
Megluminat
[Bearbeiten | Quelltext bearbeiten]In Lösung ist ein Mol Gadotersäure mit einem Mol Meglumin (N-Methyl-D-glucamin) versetzt. Man spricht in diesen Fällen auch vom Megluminsalz der Gadotersäure, Gadoterat-Meglumin, beziehungsweise Hydrogen-[1,4,7,10-tetraazacyclododecan-1,4,7,10-tetraacetato(4)]gadolinium-meglumin.[10]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Artirem (D, A, CH) mit einer Gadoliniumkonzentration von 0,0025 mmol/ml in Form von Gadoterat-Meglumin ist seit 2002 für die kontrastmittelunterstützte direkte MR-Arthrographie zugelassen (Guerbet). Die isoosmolare Lösung wird direkt in den Gelenkzwischenraum (intraartikulär) gespritzt.
Dotarem (D, A, CH) mit einer Gadoliniumkonzentration 0,5 mmol/ml (Guerbet) weist eine Zulassung für die Kontrastmitteldarstellung von ZNS-Läsionen, für Ganzkörper-MR-Kontrastmitteluntersuchungen und die kontrastmittelgestützte MR-Angiographie auf. Die übliche Dosierung beträgt 0,1 mmol/kg Körpergewicht entsprechend 0,2 ml/kg Körpergewicht intravenös. Maximal können bis zu 0,3 mmol/kg Körpergewicht bei nierengesunden Patienten verabreicht werden, allerdings ist solch eine hohe Dosis nur selten angezeigt.
Dotagita (D), Cyclolux (D) und Clariscan sind Generika mit ähnlicher Zulassung und gleicher Dosierung wie Dotarem.
Literatur
[Bearbeiten | Quelltext bearbeiten]- P. Reimer, R. Vosshenrich: Kontrastmittel in der MRT. In: Der Radiologe, 44/2004, S. 273–283.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- L. Wachsmuth: Einführung in die Grundlagen der Medizinische Physik. (PDF; 5,25 MB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ C. U. Herborn u. a.: Clinical safety and diagnostic value of the gadolinium chelate gadoterate meglumine (Gd-DOTA). In: Invest Radiol 42/2007, S. 58–62.
- ↑ P. Caravan u. a.: Gadolinium(III) Chelates as MRI Contrast Agents: Structure, Dynamics, and Applications. In: Chemical Reviews 99/1999, S. 2293–352.
- ↑ a b C. Reinländer: MRT-Kontrastmittel für das Knochenmark: Vergleichende experimentelle Untersuchungen von USPIO, SPIO und Gd-DOTA. Dissertation, Westfälische Wilhelms-Universität Münster, 2003.
- ↑ N. Kaufels: MRT-Myokarduntersuchungen zur Vitalität und Perfusion mit P792 im Vergleich zu Gd-DOTA an Schweinen nach Induktion eines akuten Herzinfarktes. Dissertation, FU Berlin, 2006.
- ↑ H. H. J. Hager, F. von Bruchhausen: Hagers Handbuch der pharmazeutischen Praxis. Springer, ISBN 3-540-62644-1.
- ↑ Kontrastmittel für Kernspintomographie und nephrogene systemische Fibrose bei schwerer Niereninsuffizienz. PR Newswire Europe Ltd.; abgerufen am 2. Juni 2008.
- ↑ K. J. Murphy u. a.: Adverse reactions to gadolinium contrast media: a review of 36 cases. In American Journal of Roentgenology, 167/1996, S. 847–9.
- ↑ H. S. Thomsen u. a.: Is there a causal relation between the administration of gadolinium-based contrast media and the development of nephrogenic systemic fibrosis (NSF)? In: Clinical Radiology, 61/2006, S. 905–6.
- ↑ H. H. J. Hager, F. von Bruchhausen: Hagers Handbuch der pharmazeutischen Praxis.