Gamma-Welle

Eine Gamma-Welle oder ein Gamma-Rhythmus ist ein Muster neuronaler Schwingungen beim Menschen mit einer Frequenz zwischen 25 und 140 Hz, wobei der 40-Hz-Punkt von besonderem Interesse ist.[1] Gamma-Rhythmen korrelieren mit großflächiger Gehirnnetzwerkaktivität und kognitiven Phänomenen wie dem Arbeitsgedächtnis, Aufmerksamkeit und Wahrnehmungsgruppierung und können durch Meditation[2] oder Neurostimulation in ihrer Amplitude erhöht werden.[1][3] Eine veränderte Gamma-Aktivität wurde bei vielen affektiven und kognitiven Störungen wie der Alzheimer-Krankheit[4] Epilepsie[5] und Schizophrenie beobachtet.[6]
Entdeckung
[Bearbeiten | Quelltext bearbeiten]Gammawellen können durch Elektroenzephalographie oder Magnetoenzephalographie nachgewiesen werden. Einer der frühesten Berichte über Gamma-Wellen-Aktivität erfolgte aus Aufzeichnungen aus dem visuellen Kortex von wachen Affen.[7] Daraufhin fokussierten sich bedeutende Forschungsaktivitäten auf die Gamma-Aktivität im visuellen Kortex.[8][9][10][11]
Gamma-Aktivität wurde auch in prämotorischen, parietalen, temporalen und frontalen kortikalen Regionen nachgewiesen und untersucht.[12] Gamma-Wellen bilden eine gemeinsame Klasse oszillatorischer Aktivität in Neuronen, die zur Basalganglienschleife (CBGTC) gehören.[13] Es wird davon ausgegangen, dass diese Aktivität Feedforward-Verbindungen zwischen verschiedenen Gehirnregionen widerspiegelt, und im Gegensatz zu Alphawellen-Feedback in denselben Regionen.[14] Es wurde auch gezeigt, dass Gamma-Oszillationen mit dem Feuern einzelner Neuronen, zumeist inhibitorischer Neuronen, in allen Stadien des Wach-Schlaf-Zyklus korrelieren.[15] Die Gamma-Wellenaktivität ist während des wachen, aufmerksamen Wachzustandes am deutlichsten ausgeprägt.[13] Die Mechanismen und Substrate, durch die die Gamma-Aktivität zur Erzeugung verschiedener Bewusstseinszustände beiträgt, sind jedoch noch unbekannt.
Kritik
[Bearbeiten | Quelltext bearbeiten]Einige Forscher bestreiten die Gültigkeit oder Aussagekraft der erfassten Gamma-Wellenaktivität mit dem an der Kopfhaut gemessenen EEG, da sich das Frequenzband der Gamma-Wellen mit dem elektromyografischen Frequenzband überschneidet. Daher könnten Gammasignalaufzeichnungen durch Muskelaktivität verunreinigt sein.[16] Studien, die lokale Muskellähmungstechniken verwenden, haben bestätigt, dass EEG-Aufzeichnungen EMG-Signale enthalten,[17][18] und diese Signale können auf lokale motorische Dynamiken wie Sakkadenrate[19] oder andere motorische Aktionen, die den Kopf betreffen, zurückgeführt werde. Fortschritte in der Signalverarbeitung und -trennung, wie z. B. die Anwendung der unabhängiger Komponentenanalyse oder anderer Techniken, die auf räumlicher Filterung basieren, wurden vorgeschlagen, um das Vorhandensein von EMG-Artefakten zu reduzieren.[16]
Zumindest in einigen EEG-Lehrbüchern wird empfohlen, eine Elektrode auf einem Augenlid sowie eine auf dem Herzen und ein Paar an den Seiten des Halses anzubringen, um Muskelsignale des Körpers aufzufangen. Im klinischen EEG wird auf dieses möglicherweise verzichtet.
Funktion
[Bearbeiten | Quelltext bearbeiten]Bewusste Wahrnehmung
[Bearbeiten | Quelltext bearbeiten]Gamma-Wellen können aufgrund ihrer offensichtlichen Synchronisierung der neuronalen Feuerraten in verschiedenen Gehirnregionen an der Bildung einer kohärenten, einheitlichen Wahrnehmung beteiligt sein, die auch als Bindungsproblem bekannt ist.[20][21][22] 1988 wurde erstmals vorgeschlagen, dass 40-Hz-Gamma-Wellen am visuellen Bewusstsein beteiligt sind,[23] z. B. oszillieren zwei Neuronen synchron (obwohl sie nicht direkt miteinander verbunden sind), wenn ein einzelnes externes Objekt ihre jeweiligen rezeptiven Felder stimuliert. Spätere Experimente zahlreicher anderer Wissenschaftler demonstrierten dieses Phänomen in einem breiten Bereich der visuellen Wahrnehmung. Insbesondere Francis Crick und Christof Koch argumentierten 1990[24], dass ein signifikanter Zusammenhang zwischen dem Bindungsproblem und dem Problem des visuellen Bewusstseins besteht und dass folglich synchrone 40-Hz-Oszillationen sowohl mit dem visuellen Bewusstsein als auch an der visuellen Bindung kausal beteiligt sein könnten. Später äußerten dieselben Autoren Skepsis gegenüber der Idee, dass 40-Hz-Oszillationen eine ausreichende Bedingung für visuelles Bewusstsein sind.[25]
Eine Reihe von Experimenten, die von Rodolfo Llinás durchgeführt wurden, stützt die Hypothese, dass die Grundlage für das Bewusstsein in Wachzuständen und im Traum 40-Hz-Oszillationen in der gesamten Hirnrinde in Form von thalamocortikalen iterativen wiederkehrenden Aktivität sind. In den Artikeln „Coherent 40-Hz Oscillation Characterizes Dream State in Humans“ (Rodolfo Llinás und Urs Ribary, Proc Natl Acad Sci USA 90:2078-2081, 1993) und „Of Dreaming and Wakefulness“ (Llinas & Pare, 1991) schlägt Llinás vor, dass die Verbindung zu einem einzigen kognitiven Ereignis durch die gleichzeitige Summierung spezifischer und unspezifischer 40-Hz-Aktivität entlang der radialen dendritischen Achse bestimmter kortikaler Elemente zustande kommen könnte, und dass die Resonanz durch den Hirnstamm moduliert wird und durch sensorischen Input im Wachzustand und intrinsische Aktivität während des Träumens Input erhält. Gemäß der Hypothese von Llinás, wird vorgeschlagen, dass die 40-Hz-Oszillation, die im Wachzustand und im Traum beobachtet wird, ein Korrelat der Wahrnehmung ist, das aus einer kohärenten 40-Hz-Resonanz zwischen thalamocortikalen spezifischen und unspezifischen Schleifen resultiert. In Llinás & Ribary (1993) schlagen die Autoren vor, dass die spezifischen Schleifen den Inhalt der Wahrnehmung liefern und dass eine unspezifische Schleife die zeitliche Bindung liefert, die für den Zusammenhang der kognitiven Erfahrung erforderlich ist.
Ein Leitartikel von Andreas K. Engel et al. definiert in der Zeitschrift Consciousness and Cognition (1999), die für zeitliche Synchronität als Grundlage des Bewusstseins plädiert, die Gamma-Wellen-Hypothese folgendermaßen:[26]
Die Hypothese besagt, dass die Synchronisation von neuronalen Entladungen der Integration verteilter Neuronen in Zellverbände dienen kann und dass dieser Prozess der Auswahl wahrnehmungs- und verhaltensrelevanter Informationen zugrunde liegt.
Aufmerksamkeit
[Bearbeiten | Quelltext bearbeiten]Der vorgeschlagene Mechanismus besteht darin, dass Gamma-Wellen über den Mechanismus für bewusste Aufmerksamkeit mit dem neuralen Bewusstsein zusammenhängen:
Die vorgeschlagene Antwort liegt in einer Welle, die vom Thalamus ausgeht und das Gehirn 40 Mal pro Sekunde von vorne nach hinten durchläuft und dabei verschiedene neuronale Schaltkreise mit gewissem Inhalt synchronisiert und dadurch diesen gewissen Inhalt in den Vordergrund der Aufmerksamkeit bringt. Bei jeglicher Schädigung des Thalamus, wird diese Welle unterbrochen, es bilden sich keine bewussten Wahrnehmungen und der Patient fällt in ein tiefes Koma.[21]
Daher lautet die Behauptung, dass, wenn all diese neuronalen Cluster während dieser vorübergehenden Perioden synchronisierten Feuerns gemeinsam oszillieren, sie dazu beitragen, Erinnerungen und Assoziationen von der visuellen Wahrnehmung zu anderen Begriffen hervorzurufen.[27] Dies bringt eine verteilte Matrix kognitiver Prozesse zusammen, um einen kohärenten, konzertierten kognitiven Akt wie die Wahrnehmung zu erzeugen. Dies hat zu Theorien geführt, wonach Gamma-Wellen mit der Lösung des Bindungsproblems verbunden sind.[20]
Gamma-Wellen werden als neurale Synchronität von visuellen Hinweisen sowohl bei bewussten als auch bei unterschwelligen Reizen beobachtet.[28][29][30][31] Diese Forschung wirft auch ein Licht darauf, wie neuronale Synchronität stochastische Resonanz im Nervensystem erklären kann.[32]
Klinische Relevanz
[Bearbeiten | Quelltext bearbeiten]Affektive Störungen
[Bearbeiten | Quelltext bearbeiten]Eine veränderte Gamma-Wellen-Aktivität wird mit affektiven Störungen wie schweren Depressionen oder bipolaren Störungen in Verbindung gebracht und könnte ein potenzieller Biomarker für die Unterscheidung zwischen unipolaren und bipolaren Störungen sein. Beispielsweise zeigen Probanden mit hohen Depressionswerten unterschiedliche Gamma-Signalisierung bei der Ausführung emotionaler, räumlicher oder arithmetischer Aufgaben. Erhöhte Gamma-Signale werden auch in Hirnregionen beobachtet, die am Ruhezustandsnetzwerk (default mode network) beteiligt sind, das normalerweise bei Aufgaben, die eine hohe Aufmerksamkeit erfordern, unterdrückt wird. Nagetiermodelle mit depressionsähnlichen Verhaltensweisen zeigen ebenfalls einen gestörten Gamma-Rhythmus.[33]
Schizophrenie
[Bearbeiten | Quelltext bearbeiten]Bei Schizophrenie wird eine verminderte Gamma-Wellen-Aktivität beobachtet. Insbesondere ist die Amplitude von Gamma-Oszillationen reduziert, ebenso wie die Synchronität verschiedener Hirnregionen, die an Aufgaben wie dem visuellen Oddball Paradigma und der Gestaltwahrnehmung beteiligt sind. Menschen mit Schizophrenie schneiden bei diesen Verhaltensaufgaben, die sich auf die Wahrnehmung und das kontinuierliche Wiedererkennungsgedächtnis beziehen, schlechter ab.[34] Es wird angenommen, dass die neurobiologische Grundlage der Gamma-Dysfunktion bei Schizophrenie in GABA-ergen Interneuronen liegt, die an bekannten Hirnwellenrhythmus erzeugenden Netzwerken beteiligt sind.[35] Die antipsychotische Behandlung, die einige Verhaltenssymptome der Schizophrenie verringert, stellt die Gamma-Synchronität nicht auf ein normales Niveau zurück.[34]
Epilepsie
[Bearbeiten | Quelltext bearbeiten]Gamma-Oszillationen werden bei der Mehrzahl epileptischer Anfälle beobachtet[5] und können bei Epilepsie zu deren Ausbruch beitragen. Visuelle Reize wie große, kontrastreiche Gitter, von denen bekannt ist, dass sie Anfälle bei lichtempfindlicher Epilepsie auslösen, führen ebenfalls zu Gamma-Oszillationen im visuellen Kortex.[36] Während eines fokalen Anfalls wird die maximale Gamma-Rhythmus-Synchronität der Interneuronen immer in der Anfallsanfangszone beobachtet, und die Synchronität breitet sich von der Anfangszone über die gesamte epileptogene Zone aus.[37]
Alzheimer-Krankheit
[Bearbeiten | Quelltext bearbeiten]Bei Patienten mit Alzheimer-Krankheit wurden eine verstärkte Gammabandleistung und verzögerte Gamma-Antworten beobachtet.[4][38] Interessanterweise weist das tg-APP-PS1-Alzheimer Mausmodell eine verringerte Gamma-Oszillationskraft im lateralen entorhinalen Kortex auf, der verschiedene sensorische Inputs an den Hippocampus weiterleitet und somit an Gedächtnisprozessen beteiligt ist, die denen bei der menschlichen Alzheimer-Krankheit ähneln.[39] Im 3xTg-Alzheimer Mausmodell wurde auch eine verringerte langsame Gamma-Leistung im Hippocampus beobachtet.[40]
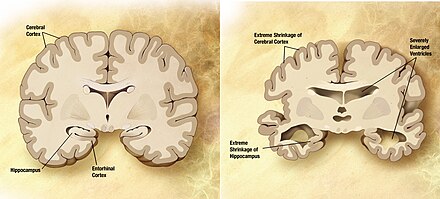
Die Gamma-Stimulation könnte ein therapeutisches Potenzial für Alzheimer und andere neurodegenerative Erkrankungen haben. Die optogenetische Stimulierung von Fast-Spike-Interneuronen im Gamma-Frequenzbereich wurde erstmals 2009 bei Mäusen nachgewiesen.[41] Die Entrainment oder Synchronisierung von Gamma-Oszillationen und Spiking auf 40 Hz im Hippocampus durch nicht-invasive Stimuli im Gamma-Frequenzband, wie z. B. blinkende Lichter oder Tonimpulse,[3] reduziert die Amyloid-Beta-Last und aktiviert Mikroglia im etablierten 5XFAD-Alzheimer Mausmodell.[42] Nachfolgende klinische Studien zur Gamma-Band-Stimulation haben leichte kognitive Verbesserungen bei Alzheimer-Patienten gezeigt, die Licht-, Schall- oder taktilen Reizen im 40-Hz-Bereich ausgesetzt waren.[1] Die genauen molekularen und zellulären Mechanismen, durch die die Gamma-Band-Stimulation die Alzheimer Pathologie verbessert, sind jedoch unbekannt.
Fragiles X-Syndrom
[Bearbeiten | Quelltext bearbeiten]Hypersensibilität und Gedächtnisdefizite beim Fragilen X-Syndrom (FXS) können mit Anomalien des Gamma-Rhythmus im sensorischen Kortex und Hippocampus zusammenhängen. Zum Beispiel wurde eine verminderte Synchronität von Gamma-Oszillationen in der Hörrinde von FXS-Patienten beobachtet. Das FXS FMR1-Knockout-Rattenmodell weist ein erhöhtes Verhältnis von langsamen (~25–50 Hz) zu schnellen (~55–100 Hz) Gamma-Wellen auf.[40]
Meditation
[Bearbeiten | Quelltext bearbeiten]Die Synchronität von Gamma-Wellen mit hoher Amplitude kann durch Meditation selbst herbeigeführt werden. Langfristig Praktizierende der Meditation wie tibetisch-buddhistische Mönche zeigen sowohl eine erhöhte Gamma-Band-Aktivität zu Beginn als auch einen signifikanten Anstieg der Gamma-Synchronität während der Meditation, wie mit einem Kopfhaut-EEG festgestellt wurde.[2] Die fMRT-Untersuchung an denselben Mönchen zeigte eine stärkere Aktivierung des rechten Inselkortex und des Nucleus caudatus während der Meditation.[43] Die neurobiologischen Mechanismen der Induktion von Gamma-Synchronität sind also hochgradig plastisch,[44] was die Hypothese stützen könnte, dass das Bewusstseinsempfinden, die Fähigkeit zur Stressbewältigung und die Konzentration, von denen oft gesagt wird, dass sie nach der Meditation verbessert werden, durch Gamma-Aktivität unterstützt werden. Auf der Jahrestagung der Society for Neuroscience im Jahr 2005 sagte der jetzige Dalai Lama, dass er ein begeisterter Freiwilliger wäre, wenn die Neurowissenschaften einen Weg vorschlagen könnten, die psychologischen und biologischen Vorteile der Meditation ohne intensive Praxis zu erreichen.[45]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- EpilepsyHealth.com – 'Eine Stichprobe aus Kapitel 3' Biofeedback, Neurofeedback und Epilepsie, Sally Fletcher (2005)
- Gamma: Einsicht und Bewusstsein… oder nur Mikrosakkaden? – Eine Zusammenfassung der jüngsten Forschung. 2009-06-26.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Barry McDermott, Emily Porter, Diarmaid Hughes, Brian McGinley, Mark Lang, Martin O'Halloran, Marggie Jones: Gamma Band Neural Stimulation in Humans and the Promise of a New Modality to Prevent and Treat Alzheimer's Disease. In: Journal of Alzheimer's disease: JAD. Band 65, Nr. 2, 2018, ISSN 1875-8908, S. 363–392, doi:10.3233/JAD-180391, PMID 30040729, PMC 6130417 (freier Volltext).
- ↑ a b Antoine Lutz, Lawrence L. Greischar, Nancy B. Rawlings, Matthieu Ricard, Richard J. Davidson: Long-term meditators self-induce high-amplitude gamma synchrony during mental practice. In: Proceedings of the National Academy of Sciences of the United States of America. Band 101, Nr. 46, 16. November 2004, ISSN 0027-8424, S. 16369–16373, doi:10.1073/pnas.0407401101, PMID 15534199, PMC 526201 (freier Volltext).
- ↑ a b Helen Thomson: How flashing lights and pink noise might banish Alzheimer's, improve memory and more. In: Nature. Band 555, Nr. 7694, 1. März 2018, ISSN 1476-4687, S. 20–22, doi:10.1038/d41586-018-02391-6, PMID 29493598.
- ↑ a b J. A. van Deursen, E. F. P. M. Vuurman, F. R. J. Verhey, V. H. J. M. van Kranen-Mastenbroek, W. J. Riedel: Increased EEG gamma band activity in Alzheimer's disease and mild cognitive impairment. In: Journal of Neural Transmission (Vienna, Austria: 1996). Band 115, Nr. 9, September 2008, ISSN 0300-9564, S. 1301–1311, doi:10.1007/s00702-008-0083-y, PMID 18607528, PMC 2525849 (freier Volltext).
- ↑ a b John R. Hughes: Gamma, fast, and ultrafast waves of the brain: their relationships with epilepsy and behavior. In: Epilepsy & Behavior: E&B. Band 13, Nr. 1, Juli 2008, ISSN 1525-5069, S. 25–31, doi:10.1016/j.yebeh.2008.01.011, PMID 18439878.
- ↑ Xiaoxuan Jia, Adam Kohn: Gamma rhythms in the brain. In: PLoS biology. Band 9, Nr. 4, April 2011, ISSN 1545-7885, S. e1001045, doi:10.1371/journal.pbio.1001045, PMID 21556334, PMC 3084194 (freier Volltext).
- ↑ J. R. Hughes: RESPONSES FROM THE VISUAL CORTEX OF UNANESTHETIZED MONKEYS. In: International Review of Neurobiology. Band 6, 1964, ISSN 0074-7742, S. 99–152, doi:10.1016/s0074-7742(08)60266-4, PMID 14282370.
- ↑ Peyman Adjamian, Ian E. Holliday, Gareth R. Barnes, Arjan Hillebrand, Avgis Hadjipapas, Krish D. Singh: Induced visual illusions and gamma oscillations in human primary visual cortex. In: The European Journal of Neuroscience. Band 20, Nr. 2, Juli 2004, ISSN 0953-816X, S. 587–592, doi:10.1111/j.1460-9568.2004.03495.x, PMID 15233769.
- ↑ Avgis Hadjipapas, Peyman Adjamian, Jennifer B. Swettenham, Ian E. Holliday, Gareth R. Barnes: Stimuli of varying spatial scale induce gamma activity with distinct temporal characteristics in human visual cortex. In: NeuroImage. Band 35, Nr. 2, 1. April 2007, ISSN 1053-8119, S. 518–530, doi:10.1016/j.neuroimage.2007.01.002, PMID 17306988.
- ↑ Suresh D. Muthukumaraswamy, Krish D. Singh: Spatiotemporal frequency tuning of BOLD and gamma band MEG responses compared in primary visual cortex. In: NeuroImage. Band 40, Nr. 4, 1. Mai 2008, ISSN 1053-8119, S. 1552–1560, doi:10.1016/j.neuroimage.2008.01.052, PMID 18337125.
- ↑ J. B. Swettenham, S. D. Muthukumaraswamy, K. D. Singh: Spectral properties of induced and evoked gamma oscillations in human early visual cortex to moving and stationary stimuli. In: Journal of Neurophysiology. Band 102, Nr. 2, August 2009, ISSN 0022-3077, S. 1241–1253, doi:10.1152/jn.91044.2008, PMID 19515947.
- ↑ Naomi S. Kort, Pablo Cuesta, John F. Houde, Srikantan S. Nagarajan: Bihemispheric network dynamics coordinating vocal feedback control. In: Human Brain Mapping. Band 37, Nr. 4, April 2016, ISSN 1097-0193, S. 1474–1485, doi:10.1002/hbm.23114, PMID 26917046, PMC 6867418 (freier Volltext).
- ↑ a b David A. McCormick, Matthew J. McGinley, David B. Salkoff: Brain state dependent activity in the cortex and thalamus. In: Current Opinion in Neurobiology. Band 31, April 2015, ISSN 1873-6882, S. 133–140, doi:10.1016/j.conb.2014.10.003, PMID 25460069, PMC 4375098 (freier Volltext).
- ↑ Timo van Kerkoerle, Matthew W. Self, Bruno Dagnino, Marie-Alice Gariel-Mathis, Jasper Poort, Chris van der Togt, Pieter R. Roelfsema: Alpha and gamma oscillations characterize feedback and feedforward processing in monkey visual cortex. In: Proceedings of the National Academy of Sciences of the United States of America. Band 111, Nr. 40, 7. Oktober 2014, ISSN 1091-6490, S. 14332–14341, doi:10.1073/pnas.1402773111, PMID 25205811, PMC 4210002 (freier Volltext).
- ↑ Michel Le Van Quyen, Lyle E. Muller, Bartosz Telenczuk, Eric Halgren, Sydney Cash, Nicholas G. Hatsopoulos, Nima Dehghani, Alain Destexhe: High-frequency oscillations in human and monkey neocortex during the wake-sleep cycle. In: Proceedings of the National Academy of Sciences of the United States of America. Band 113, Nr. 33, 16. August 2016, ISSN 1091-6490, S. 9363–9368, doi:10.1073/pnas.1523583113, PMID 27482084, PMC 4995938 (freier Volltext).
- ↑ a b Suresh D. Muthukumaraswamy: High-frequency brain activity and muscle artifacts in MEG/EEG: a review and recommendations. In: Frontiers in Human Neuroscience. Band 7, 2013, ISSN 1662-5161, S. 138, doi:10.3389/fnhum.2013.00138, PMID 23596409, PMC 3625857 (freier Volltext).
- ↑ Emma M. Whitham, Kenneth J. Pope, Sean P. Fitzgibbon, Trent Lewis, C. Richard Clark, Stephen Loveless, Marita Broberg, Angus Wallace, Dylan DeLosAngeles, Peter Lillie, Andrew Hardy, Rik Fronsko, Alyson Pulbrook, John O. Willoughby: Scalp electrical recording during paralysis: quantitative evidence that EEG frequencies above 20 Hz are contaminated by EMG. In: Clinical Neurophysiology: Official Journal of the International Federation of Clinical Neurophysiology. Band 118, Nr. 8, August 2007, ISSN 1388-2457, S. 1877–1888, doi:10.1016/j.clinph.2007.04.027, PMID 17574912.
- ↑ Emma M. Whitham, Trent Lewis, Kenneth J. Pope, Sean P. Fitzgibbon, C. Richard Clark, Stephen Loveless, Dylan DeLosAngeles, Angus K. Wallace, Marita Broberg, John O. Willoughby: Thinking activates EMG in scalp electrical recordings. In: Clinical Neurophysiology: Official Journal of the International Federation of Clinical Neurophysiology. Band 119, Nr. 5, Mai 2008, ISSN 1388-2457, S. 1166–1175, doi:10.1016/j.clinph.2008.01.024, PMID 18329954.
- ↑ Shlomit Yuval-Greenberg, Orr Tomer, Alon S. Keren, Israel Nelken, Leon Y. Deouell: Transient induced gamma-band response in EEG as a manifestation of miniature saccades. In: Neuron. Band 58, Nr. 3, 8. Mai 2008, ISSN 1097-4199, S. 429–441, doi:10.1016/j.neuron.2008.03.027, PMID 18466752.
- ↑ a b G. Buzsáki: Rhythms of the Brain. Oxford University Press, Oxford 2006, ISBN 0-19-804125-X.
- ↑ a b Robert Pollack, The Missing Moment, 1999.
- ↑ W. Singer, C. M. Gray: Visual feature integration and the temporal correlation hypothesis. In: Annual Review of Neuroscience. Band 18, 1995, ISSN 0147-006X, S. 555–586, doi:10.1146/annurev.ne.18.030195.003011, PMID 7605074.
- ↑ I. Gold: Does 40-Hz oscillation play a role in visual consciousness? In: Consciousness and Cognition. Band 8, Nr. 2, Juni 1999, ISSN 1053-8100, S. 186–195, doi:10.1006/ccog.1999.0399, PMID 10448001.
- ↑ Crick, F., & Koch, C. (1990b). Towards a neurobiological theory of consciousness. Seminars in the Neurosciences v.2, 263–275.
- ↑ Francis Crick, Christof Koch: A framework for consciousness. In: Nature Neuroscience. Band 6, Nr. 2, Februar 2003, ISSN 1097-6256, S. 119–126, doi:10.1038/nn0203-119, PMID 12555104.
- ↑ A. K. Engel, P. Fries, P. König, M. Brecht, W. Singer: Temporal binding, binocular rivalry, and consciousness. In: Consciousness and Cognition. Band 8, Nr. 2, Juni 1999, ISSN 1053-8100, S. 128–151, doi:10.1006/ccog.1999.0389, PMID 10447995.
- ↑ Daniel Baldauf, Robert Desimone: Neural mechanisms of object-based attention. In: Science (New York, N.Y.). Band 344, Nr. 6182, 25. April 2014, ISSN 1095-9203, S. 424–427, doi:10.1126/science.1247003, PMID 24763592.
- ↑ Lucia Melloni, Carlos Molina, Marcela Pena, David Torres, Wolf Singer, Eugenio Rodriguez: Synchronization of neural activity across cortical areas correlates with conscious perception. In: The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. Band 27, Nr. 11, 14. März 2007, ISSN 1529-2401, S. 2858–2865, doi:10.1523/JNEUROSCI.4623-06.2007, PMID 17360907, PMC 6672558 (freier Volltext).
- ↑ Markus Siegel, Tobias H. Donner, Robert Oostenveld, Pascal Fries, Andreas K. Engel: Neuronal synchronization along the dorsal visual pathway reflects the focus of spatial attention. In: Neuron. Band 60, Nr. 4, 26. November 2008, ISSN 1097-4199, S. 709–719, doi:10.1016/j.neuron.2008.09.010, PMID 19038226.
- ↑ Georgia G. Gregoriou, Stephen J. Gotts, Huihui Zhou, Robert Desimone: High-frequency, long-range coupling between prefrontal and visual cortex during attention. In: Science (New York, N.Y.). Band 324, Nr. 5931, 29. Mai 2009, ISSN 1095-9203, S. 1207–1210, doi:10.1126/science.1171402, PMID 19478185, PMC 2849291 (freier Volltext).
- ↑ Daniel Baldauf, Robert Desimone: Neural mechanisms of object-based attention. In: Science (New York, N.Y.). Band 344, Nr. 6182, 25. April 2014, ISSN 1095-9203, S. 424–427, doi:10.1126/science.1247003, PMID 24763592.
- ↑ Lawrence M. Ward, Sam M. Doesburg, Keiichi Kitajo, Shannon E. MacLean, Alexa B. Roggeveen: Neural synchrony in stochastic resonance, attention, and consciousness. In: Canadian Journal of Experimental Psychology = Revue Canadienne De Psychologie Experimentale. Band 60, Nr. 4, Dezember 2006, ISSN 1196-1961, S. 319–326, doi:10.1037/cjep2006029, PMID 17285879.
- ↑ Paul J. Fitzgerald, Brendon O. Watson: Gamma oscillations as a biomarker for major depression: an emerging topic. In: Translational Psychiatry. Band 8, Nr. 1, 4. September 2018, ISSN 2158-3188, S. 177, doi:10.1038/s41398-018-0239-y, PMID 30181587, PMC 6123432 (freier Volltext).
- ↑ a b Bruce Bower: Synchronized Thinking. In: Science News. Band 166, Nr. 20, 13. November 2004, S. 310, doi:10.2307/4015767.
- ↑ Peter J. Uhlhaas, Wolf Singer: Abnormal neural oscillations and synchrony in schizophrenia. In: Nature Reviews. Neuroscience. Band 11, Nr. 2, Februar 2010, ISSN 1471-0048, S. 100–113, doi:10.1038/nrn2774, PMID 20087360.
- ↑ Dora Hermes, Dorothée G.A. Kasteleijn-Nolst Trenité, Jonathan Winawer: Gamma oscillations and photosensitive epilepsy. In: Current Biology. Band 27, Nr. 9, Mai 2017, S. R336–R338, doi:10.1016/j.cub.2017.03.076, PMID 28486114, PMC 5438467 (freier Volltext) – (elsevier.com [abgerufen am 16. Januar 2023]).
- ↑ Yosuke Sato, Simeon M. Wong, Yasushi Iimura, Ayako Ochi, Sam M. Doesburg, Hiroshi Otsubo: Spatiotemporal changes in regularity of gamma oscillations contribute to focal ictogenesis. In: Scientific Reports. Band 7, Nr. 1, 24. August 2017, ISSN 2045-2322, S. 9362, doi:10.1038/s41598-017-09931-6, PMID 28839247, PMC 5570997 (freier Volltext).
- ↑ Erol Başar, Derya Durusu Emek-Savaş, Bahar Güntekin, Görsev G. Yener: Delay of cognitive gamma responses in Alzheimer's disease. In: NeuroImage. Clinical. Band 11, 2016, ISSN 2213-1582, S. 106–115, doi:10.1016/j.nicl.2016.01.015, PMID 26937378, PMC 4753813 (freier Volltext).
- ↑ Alexandra S. Klein, José R. Donoso, Richard Kempter, Dietmar Schmitz, Prateep Beed: Early Cortical Changes in Gamma Oscillations in Alzheimer's Disease. In: Frontiers in Systems Neuroscience. Band 10, 2016, ISSN 1662-5137, S. 83, doi:10.3389/fnsys.2016.00083, PMID 27833535, PMC 5080538 (freier Volltext).
- ↑ a b Alexandra J. Mably, Laura Lee Colgin: Gamma oscillations in cognitive disorders. In: Current Opinion in Neurobiology. Band 52, Oktober 2018, ISSN 1873-6882, S. 182–187, doi:10.1016/j.conb.2018.07.009, PMID 30121451, PMC 6139067 (freier Volltext).
- ↑ Jessica A. Cardin, Marie Carlén, Konstantinos Meletis, Ulf Knoblich, Feng Zhang, Karl Deisseroth, Li-Huei Tsai, Christopher I. Moore: Driving fast-spiking cells induces gamma rhythm and controls sensory responses. In: Nature. Band 459, Nr. 7247, 4. Juni 2009, ISSN 1476-4687, S. 663–667, doi:10.1038/nature08002, PMID 19396156, PMC 3655711 (freier Volltext).
- ↑ Hannah F. Iaccarino, Annabelle C. Singer, Anthony J. Martorell, Andrii Rudenko, Fan Gao, Tyler Z. Gillingham, Hansruedi Mathys, Jinsoo Seo, Oleg Kritskiy, Fatema Abdurrob, Chinnakkaruppan Adaikkan, Rebecca G. Canter, Richard Rueda, Emery N. Brown, Edward S. Boyden, Li-Huei Tsai: Gamma frequency entrainment attenuates amyloid load and modifies microglia. In: Nature. Band 540, Nr. 7632, 7. Dezember 2016, ISSN 1476-4687, S. 230–235, doi:10.1038/nature20587, PMID 27929004, PMC 5656389 (freier Volltext).
- ↑ The 14th Dalai Lama: How Thinking Can Change the Brain. 16. Januar 2023, abgerufen am 16. Januar 2023 (englisch).
- ↑ Kaufman, Marc (January 3, 2005). „Meditation Gives Brain a Charge, Study Finds“. The Washington Post. Abgerufen am 3. Mai 2010.
- ↑ Reiner PB (2009-05-26). „Meditation On Demand“. Scientific American. Abgerufen am 16. Dezember 2019.