Aminoacetonitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aminoacetonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H4N2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 56,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
5,34 (25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Aminoacetonitril ist eine chemische Verbindung aus der Gruppe der Nitrile. Es ist ein chemischer Verwandter und möglicher direkter Vorläufer der Aminosäure Glycin.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Aminoacetonitril fanden Forscher des Bonner Max-Planck-Instituts für Radioastronomie in Zusammenarbeit mit Astronomen aus Australien und den USA in einer dichten, heißen Gaswolke innerhalb des Sternentstehungsgebiets Sagittarius B2. Dieses von den Astronomen auch „Heimat der großen Moleküle“ genannte Objekt besitzt nur einen Durchmesser von 0,3 Lichtjahren und wird von einem tief im Inneren verborgenen jungen Stern aufgeheizt. In diesem fanden sich die meisten der bisher im Weltraum nachgewiesenen organischen Moleküle – darunter so komplexe Verbindungen wie Ethylalkohol, Formaldehyd, Ameisensäure, Essigsäure, Glycolaldehyd und Ethylenglycol.[4][5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Aminoacetonitril ist das einfachste Strecker-Addukt, da es bei der Kondensation von Formaldehyd mit Blausäure und Ammoniak entsteht.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Eigenschaften
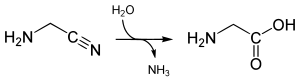
[Bearbeiten | Quelltext bearbeiten]Durch Verseifung der Nitrilgruppe (Vervollständigung der Strecker-Synthese) unter Abspaltung von Ammoniak kann Glycin erzeugt werden:[6]
Toxizität
[Bearbeiten | Quelltext bearbeiten]Aminoacetonitril wirkt toxisch und schädigt das Bindegewebe, vermutlich durch die Bildung von Cyanid durch Zersetzung. Letzteres hemmt das Enzym Cytochrom-c-Oxidase, welches auch im Bindegewebe enthalten ist.[7]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Aminoacetonitril. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Gruppenbeitragsmethode nach Joback, K. G.; Reid, R. C.; Chem. Engng. Commun. 57 (1987) S. 233–243.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ a b Datenblatt Aminoacetonitrile bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- ↑ Aminoacetonitril im Weltall nachgewiesen (Portal für Organische Chemie).
- ↑ A. Belloche, H. S. P. Müller, K. M. Menten, P. Schilke, C. Comito: Complex organic molecules in the interstellar medium: IRAM 30 m line survey of Sagittarius B2(N) and (M) (Corrigendum). In: Astronomy & Astrophysics. Band 561, Januar 2014, S. C1, doi:10.1051/0004-6361/201321096e.
- ↑ a b Guy Bouchoux, Jean‐Claude Guillemin, Nadège Lemahieu, Terrance B. McMahon: Protonation thermochemistry of aminoacetonitrile. In: Rapid Communications in Mass Spectrometry. Band 20, Nr. 8, 30. April 2006, S. 1187–1191, doi:10.1002/rcm.2437.
- ↑ J. J. Clemmons, E. B. Jackson: INHIBITION OF CYTOCHROME OXIDASE BY AMINOACETONITRILE. In: The Journal of Experimental Medicine. Band 115, Nr. 3, 1. März 1962, S. 555–562, doi:10.1084/jem.115.3.555, PMID 13879920, PMC 2137506 (freier Volltext).


