Arsensäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
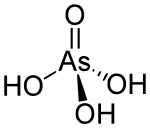
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Arsensäure | |||||||||||||||
| Andere Namen |
Arsen(V)-säure | |||||||||||||||
| Summenformel | H3AsO4 | |||||||||||||||
| Kurzbeschreibung |
durchsichtig bis weißer, geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 141,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,50 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
120 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4]; zulassungspflichtig[5] | |||||||||||||||
| MAK |
| |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Arsensäure (auch Arsen(V)-säure genannt) ist die von Diarsenpentaoxid abgeleitete Säure mit der Summenformel H3AsO4. Es ist eine dreiprotonige, mittelstarke Säure und etwa so stark wie Phosphorsäure. Die Salze der Arsensäure heißen Arsenate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Arsensäure bildet sich durch Lösen von Arsenpentaoxid in Wasser:
Das Gleichgewicht dieser chemischen Reaktion kann zur linken Seite verschoben werden. Durch Entzug von Wasser beispielsweise mit Phosphorpentoxid bildet sich aus Arsensäure wieder Arsenpentaoxid.
Eine weitere Reaktion zur Darstellung von Arsensäure ist die Oxidation von Arsen oder Arsen(III)-oxid mit Hilfe konzentrierter Salpetersäure. Dabei bildet sich das Hemihydrat:
Das Dihydrat (H3AsO4 · 2H2O) ist nur über die Kristallisation während mehrerer Tage bei −30 °C zugänglich.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Feste Arsensäure entzieht der Luft sehr schnell Wasser und bildet Hydrate: H3AsO4 · ½H2O beziehungsweise H3AsO4 · 2H2O bei −30 °C. Beim Erhitzen auf 100 °C entsteht As2O5 · 1,66H2O, über 300 °C wird alles Wasser freigesetzt.
Eine gesättigte wässrige Lösung ist ungefähr 80%ig.
Sicherheitshinweise und gesetzliche Regelungen
[Bearbeiten | Quelltext bearbeiten]Arsensäure wurde im Dezember 2011 aufgrund ihrer Einstufung als krebserzeugend (Carc. 1A) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[4] Im August 2014 wurde Arsensäure danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 22. August 2017 aufgenommen.[8] Als Arsenverbindung unterliegt Arsensäure außerdem den Beschränkungen im Anhang XVII, Nummer 19 der REACH-Verordnung.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k Eintrag zu Arsensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Inorganic Acids and Bases, S. 8-40.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Arsensäure und seine Salze, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 9. Januar 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7778-39-4 bzw. Arsensäure), abgerufen am 24. Oktober 2016.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 601.
- ↑ Verordnung (EU) Nr. 895/2014
- ↑ ECHA: Liste der beschränkten Stoffe – Anhang XVII der REACH-Verordnung, abgerufen am 5. September 2020.
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Ätzender Stoff
- Krebserzeugender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Zulassungspflichtiger Stoff nach REACH-Anhang XIV
- Anorganische Säure
- Arsenverbindung
- Sauerstoffverbindung
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 19
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 75







