Oxepan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Oxepan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H12O | |||||||||||||||
| Kurzbeschreibung |
klare, leicht gelbliche Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,90 g·cm−3[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Brechungsindex |
1,4400 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Oxepan ist eine chemische Verbindung aus der Gruppe der gesättigten Heterocyclen. Es handelt sich um den einfachsten siebengliedrigen sauerstoffhaltigen Heteroaliphaten.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung von Oxepan gelingt aus der Cyclisierung von 1,6-Hexandiol in DMSO bei 190 °C, jedoch nur in schlechter Ausbeute.[5] Eine weitere Möglichkeit, die jedoch eine vergleichbar schlechte Ausbeute liefert, ist die Cyclisierung von 1,6-Dichlorhexan mit Kaliumhydroxid.[6]
Reaktionen
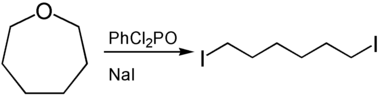
[Bearbeiten | Quelltext bearbeiten]Oxepane können durch Ringöffnung zur Darstellung von α,ω-funktionalisierten Derivaten des Hexans genutzt werden. Zur Ringöffnung können Lewis- oder Brønsted-Säuren herangezogen werden. So liefert die Umsetzung von Oxepan mit Phenyldichlorphosphat und Natriumiodid 1,6-Diiodhexan.[7]
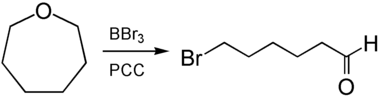
Aus der Reaktion mit Bortribromid mit anschließender Oxidation durch PCC ist 6-Bromhexanal zugänglich.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Hexamethylene Oxide bei TCI Europe, abgerufen am 31. Oktober 2016.
- ↑ A. Müller, W. Vanc, in: Monatsh. Chem., 1947, 77, S. 259–263.
- ↑ A. Misono, T. Osa, Y. Sanami, in: Bull. Chem. Soc. Jpn., 1968, 41, S. 2447–2453.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-408.
- ↑ V. J. Traynelis, W. L. Hergenrother, H. T. Hanson, J. A. Valicenti, in: J. Org. Chem., 1964, 29, S. 123–129.
- ↑ H. A. Zahalka, Y. Sasson, in: Synthesis, 1986, 9, S. 763–765.
- ↑ H.-J. Liu, L. M. Shewchuk, M. Llinas-Brunet, in: Heterocycles, 1986, 24, S. 3043–3046.
- ↑ S. U. Kulkarni, U. Surendra, V. D. Patil, in: Heterocycles, 1982, 18, S. 163–167.