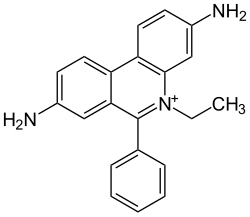
Ethidiumbromid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethidiumbromid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H20BrN3 | |||||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 394,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,01 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ethidiumbromid (oft abgekürzt als EtBr, nicht zu verwechseln mit Ethylbromid), auch Ethidium oder Homidium genannt, ist ein roter Phenanthridin-Farbstoff, der in der Molekularbiologie zum Nachweis der Nukleinsäuren, DNA und RNA, verwendet wird.[6] Ethidiumbromid ist das homologe Ethylderivat von Dimidiumbromid.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Auf der Suche nach neuen Wirkstoffen gegen Trypanosomen-Erkrankungen wurde Ethidiumbromid 1938 von Carl Hamilton Browning synthetisiert (Substanz Nr. 897). Ethidiumbromid zeigte antitrypanosomale Aktivität gegen Trypanosoma congolense- Infektionen bei Mäusen und Rindern.[7] Ethidiumbromid wurde 1952 unter dem Handelsnamen Ethidium® auf den Markt gebracht und extensiv in den 1960er und 1970er Jahren zur Behandlung und Prophylaxe von Infektionen mit Trypanosomen bei Rindern genutzt. Zu diesem Zweck wird Ethidiumbromid bis heute eingesetzt; eine Dosis von 1 mg/kg Körpergewicht dient sowohl der Behandlung infizierter Tiere als auch der Infektionsprophylaxe, die bis zu 3 Monate anhält.
1965 wurde entdeckt, dass Ethidiumbromid an DNA bindet[8] und dass sich dabei sein Absorptionsspektrum verändert.[9] 1972 wurde Ethidiumbromid erstmals zum Anfärben von DNA in Gelelektrophoresen eingesetzt.[10][11][12]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Das Absorptionsspektrum von Ethidiumbromid in Wasser zeigt zwei Absorptionsbanden im UV-Bereich (λ = 210 nm, ε = 40000; λ = 285, ε = 50000) mit zwei Schultern (λ = 316 nm, ε = 5000–10000; λ = 343 nm, ε = 200–500) und eine im sichtbaren Bereich (λ = 480 nm, ε = 5300).[13][14]
Ethidiumbromid interkaliert in Nukleinsäuren und verändert dabei sein Absorptionsspektrum. Das Emissionsspektrum bleibt nahezu unverändert. Durch die Interkalation von Ethidiumbromid in Nukleinsäuren nimmt die Intensität der Fluoreszenz-Emission um den Faktor 50–100 zu.
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Ethidiumbromid wird in der Molekularbiologie zum Anfärben von Nukleinsäuren bei der Gelelektrophorese verwendet. Während die negativ geladene Nukleinsäure zur positiv geladenen Anode wandert, wandert das positiv geladene Ethidiumbromid entgegengesetzt. Dabei interkalieren einzelne Ethidiumbromid-Moleküle zwischen die Basen der DNA bzw. RNA (Einlagerung im Abstand von 10 Basenpaaren), wodurch sich das Anregungsspektrum von Ethidiumbromid verändert und so die Fluoreszenz der Substanz bei Anregung mit ultraviolettem Licht stark erhöht wird. Auf diese Weise leuchten im Agarosegel die Stellen, an denen sich Nukleinsäuren befinden, hell auf, während Stellen ohne Nukleinsäuren dunkel erscheinen.[15] Die Lichtintensität ist dabei proportional zur vorliegenden DNA/RNA-Konzentration sowie zur Länge der Nukleinsäure. Die verwendete Ethidiumbromid-Konzentration im Agarosegel liegt üblicherweise bei 0,1–0,5 µg/ml.
In der Durchflusszytometrie wird Ethidiumbromid zur Bestimmung der Zellviabilität verwendet.
Ethidiumbromid inhibiert in niedrigen Konzentrationen (0,1–2 µg/ml) spezifisch die Replikation der mitochondrialen DNA (mtDNA) in Eukaryoten. Es wird daher zur Generierung mtDNA-defizienter Zellen (rho zero cells, ρ0) verwendet.
Alternativen
[Bearbeiten | Quelltext bearbeiten]Um sich nicht den Gefahren von Ethidiumbromid auszusetzen, können Alternativen, wie zum Beispiel SYBR Green I oder SYBR Gold, verwendet werden.[16] Solche sind jedoch sehr teuer und deren Toxizität und Mutagenität unbekannt, so dass in vielen Laboren immer noch Ethidiumbromid als Färbemittel eingesetzt wird.
Weitere Alternativen sind Methylenblau, Nilblau A, Acridinorange.
Risiken
[Bearbeiten | Quelltext bearbeiten]Die Senatskommission der Deutschen Forschungsgemeinschaft zur Prüfung gesundheitsschädlicher Arbeitsstoffe hat Ethidiumbromid als karzinogen, Kategorie 3 (Arbeitsstoffe mit Verdacht auf krebserzeugende Wirkung) eingestuft.[17] Im National Toxicology Program (Executive Summary) der National Institutes of Health wird dazu bemerkt, dass kein Fall bekannt ist, wo Ethidiumbromid tatsächlich einen Tumor ausgelöst hätte. In-vivo-Untersuchungen des National Toxicology Program an Ratten und Mäusen konnten keinerlei krebserzeugende Wirkung nachweisen. Stattdessen gab es einige Studien zu Beginn der 1970er Jahre, in denen eine antitumorgene Wirkung von Ethidiumbromid beschrieben wurde.[18][19] In einer aktuelleren Studie konnte gezeigt werden, dass EtBr als Topoisomerase 1-Gift wirkt, vergleichbar mit diversen Zytostatika, welche zur Krebsbehandlung von Menschen eingesetzt werden.[20] Eine subchronische Karzinogenitätsstudie in Mäusen, welche an der Universität Düsseldorf durchgeführt wurde, konnte ebenfalls keine mutagenen Effekte nachweisen.[21]
Ethidiumbromid wirkt erst in sehr hohen Konzentrationen akut toxisch. Die LD50 von Ethidiumbromid für Ratten bei oraler Applikation wird mit 1503 mg/kg Körpergewicht angegeben.[5]
Sicherheit
[Bearbeiten | Quelltext bearbeiten]Ethidiumbromid ist möglicherweise erbgutverändernd. Die Verwendung von Handschuhen im Umgang mit Ethidiumbromid oder mit Ethidiumbromid-gefärbten Gelen ist dringend angezeigt, da Ethidiumbromid über die Haut resorbiert wird. Untersuchungen der Abteilung Arbeitssicherheit der Universität Freiburg haben gezeigt, dass die in Laboren üblichen dünnwandigen Einmalhandschuhe aus Latex bereits nach sehr kurzer Zeit von Ethidiumbromid durchdrungen werden (1%ige Lösung: ca. 30 s; 0,1%ige Lösung: ca. 60 s). Handschuhe aus Nitril zeigten beim Test unter denselben Bedingungen keine nachweisbare Durchdringung und sind daher vorzuziehen. Latexhandschuhe sollten allenfalls als kurzfristiger Spritzschutz Verwendung finden.
Die Verwendung von gebrauchsfertigen Lösungen, beispielsweise einer Konzentration von 10 mg/ml in Wasser, wird empfohlen, um Staubentwicklung zu vermeiden.
Für Ethidiumbromid ist kein MAK-Wert festgelegt, da für krebserzeugende Arbeitsstoffe, krebsverdächtige Stoffe und Mutagene keine Wirkungsgrenzen ermittelt werden können.
Entsorgung
[Bearbeiten | Quelltext bearbeiten]Ethidiumbromidhaltige Abfälle dürfen nicht ins Abwasser gelangen und müssen vor der Entsorgung inaktiviert werden, z. B. durch Adsorption des Ethidiumbromids an Aktivkohle (1 mg Aktivkohle adsorbiert ca. 50 µl einer frisch angesetzten 1%igen EtBr-Lösung). Das ethidiumbromidfreie Eluat wird meist über den Ausguss entsorgt. Die beaufschlagte Aktivkohle wird entweder im Muffelofen ausgeglüht (Pyrolyse) oder als fester Sonderabfall getrennt gesammelt. Fertige Adsorber sind kommerziell erhältlich.
Sonstiges
[Bearbeiten | Quelltext bearbeiten]Hinweis zur Abkürzung: die in den Biowissenschaften regelmäßig verwendete Abkürzung EtBr für Ethidiumbromid kann in chemischem Zusammenhang zu Verwechselungen führen. In der organischen Chemie ist Et die auch in internationalen Publikationen anerkannte Abkürzung für die Ethylgruppe –CH2–CH3, somit steht EtBr in der Chemie für Ethylbromid.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Laborjournal online: Ethidiumbromid – Ein Mythos auf dem Prüfstand und Eine etwas wunderliche Nachlese
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Homidiumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c d e Eintrag zu Ethidiumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. November 2021. (JavaScript erforderlich)
- ↑ Eintrag zu 3,8-diamino-1-ethyl-6-phenylphenantridinium bromide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Homidium bromide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 7. Dezember 2016. (Seite nicht mehr abrufbar)
- ↑ a b ChemDAT ( vom 12. April 2014 im Internet Archive). Die Merck Chemie Datenbank.
- ↑ Mikrobiologische Charakterisierung aquatischer Semente: Methodensammlung, S. 47–58, Oldenbourg Verlag, ISBN 3-486-26435-4.
- ↑ Browning, C.H. et al. (1938): The trypanocidal action of certain phenanthridinium compounds. In: J. Path. Bact. Bd. 46, S. 203–204. doi:10.1002/path.1700460121
- ↑ Waring, M.J. (1965): Complex formation between ethidium bromide and nucleic acids. In: J. Mol. Biol. Bd. 13, S. 269–282, PMID 5859041.
- ↑ Le Pecq, J.B. and Paoletti, C. (1966): A new fluorometric method for RNA and DNA determination. Anal. Biochem. Bd. 17, S. 100–107, PMID 6008008.
- ↑ Borst, P. (2005): Ethidium DNA agarose gel electrophoresis: how it started. In: IUBMB Life. Bd. 57, S. 745–747, PMID 16511967.
- ↑ Aaij, C. und Borst, P. (1972): The gel electrophoresis of DNA. In: Biochim. Biophys. Acta. Bd. 269, S. 192–200, PMID 5063906.
- ↑ Sharp, P.A., Sugden, B., Sambrook, J. (1973): Detection of two restriction endonuclease activities in Haemophilus parainfluenzae using analytical agarose – ethidium bromide electrophoresis. In: Biochemistry. Bd. 12, S. 3055–3063, PMID 4354250.
- ↑ Bruce Hudson, Russell Jacobs: The ultraviolet transitions of the ethidium cation. In: Biopolymers. Band 14, Nr. 6, 1975, S. 1309–1312, doi:10.1002/bip.1975.360140619.
- ↑ Eintrag zu Ethidium Bromide in der Hazardous Substances Data Bank (via PubChem), abgerufen am 18. November 2014.
- ↑ M. Holtzhauer: Biochemische Labormethoden, S. 51, 3. Auflage, Springer Verlag, Berlin, 2009, ISBN 3-540-62435-X.
- ↑ Huang, Q. and Fu, W.L. (2005): Comparative analysis of the DNA staining efficiencies of different fluorescent dyes in preparative agarose gel electrophoresis. In: Clin. Chem. Lab. Med. Bd. 43, S. 841–842, PMID 16201894.
- ↑ Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: MAK- und BAT-Werte-Liste 2021. 57. Mitteilung. In: Deutsche Forschungsgemeinschaft (Hrsg.): Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. PUBLISSO, 2021, ISBN 978-3-9822007-1-2, doi:10.34865/mbwl_2021_deu.
- ↑ National Toxicology Program: Testing Status: Ethidium bromide
- ↑ National Toxicology Program: Executive Summary: Ethidium Bromide.
- ↑ Gentry AC, Juul S, Veigaard C, Knudsen BR, Osheroff N.: The geometry of DNA supercoils modulates the DNA cleavage activity of human topoisomerase I. In: Nucleic Acids Research. 39. Jahrgang, Nr. 3, 2011, S. 1014–1022, doi:10.1093/nar/gkq822.
- ↑ Marossek V: Identifizierung und Charakterisierung molekularbiologischer Veränderungen am Beispiel des Tumorsuppressors p53 in der Tamoxifen- bzw. Bromdeoxyuridin-induzierten Karzinogenese im Labornager. 18. Dezember 2001, abgerufen am 8. September 2011.

