Indolalkaloide
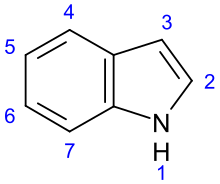
Indolalkaloide bilden die größte Alkaloidgruppe. Zu ihr gehören weit mehr als 1000 Vertreter. Charakterisiert sind sie durch den Indol- oder Indolin- (2,3-Dihydroindol-)-Grundkörper.[1] Entsprechend ihrer biogenetischen Herkunft aus Tryptophan tragen sie fast alle in Stellung 3 des Indolringes einen 2-Aminoethylrest, der meistens in einen oder mehrere, am Indol anellierte Ringe integriert ist.[2]
Beispiele: Ajmalin, Ergotamin, Yohimbin, Reserpin, Strychnin, Ibogain
Einige Vertreter entstehen durch Verknüpfung von zwei substituierten Indolgrundkörpern. Sie werden als Bis-Indol-Alkaloide bezeichnet.
Vorkommen in der Natur
[Bearbeiten | Quelltext bearbeiten]Indolalkaloide kommen z. B. in der Steppenraute (Peganum harmala L.) vor. Darin finden sich Harman-Alkaloide, wie Harmin, Harmalin und Tetrahydroharmin. Die Kalabarbohne (Physostigma venenosum) enthält Physostigmin.[3] Einige Vertreter der Pflanzenfamilie Convolvulaceae, wie z. B. Ipomoea violacea und Turbina corymbosa, enthalten Mutterkornalkaloide.[4] Viele monoterpenoide Indolalkaloide findet man in drei Familien von zweikeimblättrigen Pflanzen: Apocynaceae (Rauvolfia und Catharanthus), Rubiaceae (Corynanthe) und Loganiaceae (Strychnos).[5][6]
Indolalkaloide findet man auch in Pilzen. Psilocybinhaltige Pilze enthalten Derivate des Tryptamins und Claviceps enthält Derivate der Lysergsäure.[3] Die Haut mehrerer Echter Kröten (Bufo) enthält ebenfalls Tryptamin-Derivate (Bufotenin). Die Haut von Bufo alvarius (einer Krötenart) enthält 5-Methoxy-N,N-dimethyltryptamin.[7] Serotonin, ein wichtiger Neurotransmitter in vielen Tierarten, kann als ein einfaches Indolalkaloid betrachtet werden.[8]
-
Steppenraute enthält β-Carbolinalkaloide
-
Ipomoea violacea enthält Ergoline
-
Alstonia macrophylla enthält Corynanthe-Alkaloide
-
Rauwolfia serpentina enthält Corynanthe-Alkaloide
-
Catharanthus roseus enthält monoterpenoide Indolalkaloide
-
Die Kröte Bufo alvarius enthält Bufotenin und 5-Methoxy-N,N-dimethyltryptamin
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Hesse: Alkaloidchemie. Georg Thieme Verlag, 1978, ISBN 3-13-381801-5.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 480–482.
- ↑ a b Waksmundzka-Hajnos, Monika; Sherma, Joseph; Kowalska, Teresa: Thin layer chromatography in phytochemistry. CRC Press, 2008, ISBN 978-1-4200-4677-9, S. 625–626 (google.com).
- ↑ Tadeusz Aniszewski: Alkaloids – secrets of life. Elsevier, Amsterdam 2007, ISBN 978-0-444-52736-3, S. 39 (google.de).
- ↑ Monika Waksmundzka-Hajnos, Joseph Sherma, Teresa Kowalska: Thin layer chromatography in phytochemistry. CRC Press, 2008, ISBN 978-1-4200-4677-9, S. 626 (google.com).
- ↑ Tadeusz Aniszewski: Alkaloids – secrets of life. Elsevier, Amsterdam 2007, ISBN 978-0-444-52736-3, S. 37–39 (google.de).
- ↑ Michael E. Peterson, Patricia A. Talcott: Small Animal Toxicology. Saunders, 2005, ISBN 0-7216-0639-3, S. 1086 (google.de).
- ↑ Monika Waksmundzka-Hajnos, Joseph Sherma, Teresa Kowalska: Thin layer chromatography in phytochemistry. CRC Press, 2008, ISBN 978-1-4200-4677-9, S. 625 (google.com).







