Cystein
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
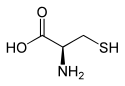
| Struktur von L-Cystein, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cystein | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H7NO2S | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit charakteristischem Geruch [3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 121,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
220–228 °C [3] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cystein (ausgesprochen: Cyste-ín), abgekürzt Cys oder C, ist eine α-Aminosäure mit der Seitenkette –CH2–SH, die Schwefel enthält. Nur die natürlich vorkommende enantiomere Form L-Cystein [Synonym: (R)-Cystein] ist eine proteinogene Aminosäure; sie kann beim Erwachsenen in der Leber aus der ebenfalls schwefelhaltigen Aminosäure L-Methionin gebildet werden.
Durch Oxidation der Sulfhydrylgruppen können zwei Cysteinreste miteinander eine Disulfidbrücke bilden, womit Cystin entsteht. Solche Disulfidbrücken stabilisieren in zahlreichen Proteinen deren Tertiär- und Quartärstruktur und sind für Bildung und Erhalt funktionstragender Konformationen von Bedeutung.
Isomerie
[Bearbeiten | Quelltext bearbeiten]Cystein kann in den enantiomeren Formen D und L vorliegen, wobei in Proteinen nur die L-Form vorkommt. Da Schwefel nach der CIP-Nomenklatur eine höhere Priorität als Sauerstoff zugewiesen wird, stellt L-Cystein – wie ebenso das Disulfid L-Cystin und auch L-Selenocystein – eine proteinogene Aminosäure mit (R)-Konfiguration dar.
In diesem Artikel betreffen die Angaben zur Physiologie allein das L-Cystein. Wird ohne jeden Zusatz von Cystein gesprochen, ist gemeinhin L-Cystein gemeint. Das racemische DL-Cystein [Synonym: (RS)-Cystein] und enantiomerenreines D-Cystein [Synonym: (S)-Cystein] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung.
Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.[7]
| Enantiomere von Cystein | ||
| Name | L-Cystein | D-Cystein |
| Andere Namen | (R)-Cystein | (S)-Cystein |
| Strukturformel |  |
|
| CAS-Nummer | 52-90-4 | 921-01-7 |
| 3374-22-9 (Racemat) | ||
| EG-Nummer | 200-158-2 | 213-062-0 |
| 222-160-2 (Racemat) | ||
| ECHA-Infocard | 100.000.145 | 100.011.875 |
| 100.020.147 (Racemat) | ||
| PubChem | 5862 | 92851 |
| 594 (Racemat) | ||
| DrugBank | DB00151 | DB03201 |
| − (Racemat) | ||
| FL-Nummer | 17.033 | − |
| Wikidata | Q186474 | Q16633812 |
| Q27089394 (Racemat) | ||
Geschichte
[Bearbeiten | Quelltext bearbeiten]L-Cystein wurde zuerst 1810 als Cystin durch den englischen Naturwissenschaftler William Hyde Wollaston aus Nierensteinen isoliert,[8] woraus sich auch der Name (altgriechisch κύστις küstis, deutsch ‚Blase‘, ‚Harnblase‘) ableitet. Wollaston hat die neue Substanz zunächst als „cystic oxide“ bezeichnet, bevor Jöns Jakob Berzelius ihr später den Namen Cystin gab. Die erstmalige Isolierung aus Eiweißen gelang dem schwedischen Chemiker Graf Mörner im Jahr 1899.[9] Zuvor war es dem Freiburger Professor Eugen Baumann durch die Reduktion von Cystin erstmals gelungen,[10] die eigentliche Aminosäure Cystein zu erhalten. Emil Fischer konnte schließlich die Strukturformel von Cystein zweifelsfrei aufklären.[11]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]L-Cystein findet sich in Proteinen, aber nicht alle Proteine enthalten Cystein. Rechnerische Analyse von 207 nicht miteinander verwandten Proteinen ergab einen durchschnittlichen Masseanteil von 2,6 % Cystein; in der gleichen Analyse wurde für Molkenprotein 1,7 % Cystein bestimmt.[12]

Hoher L-Cystein-Gehalt (und damit hohe Stabilität) findet sich z. B. in Keratin: Feder-Keratin enthält etwa 7 %, Woll-Keratin 11 bis 17 % Cystein.[13] Aber auch sehr kleine sterisch stabilisierte Proteine wie Schlangentoxine (Myotoxin, Neurotoxin etc.; etwa 40 bis 70 Aminosäuren) enthalten 10 bis 14 % Cystein in Form von Cystin (Disulfidbrücken).
Lebensmittel
[Bearbeiten | Quelltext bearbeiten]Die folgenden Beispiele geben einen Überblick über Cysteingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Cystein am Gesamtprotein angegeben.[14]
| Lebensmittel | Gesamtprotein | Cystein | Anteil |
|---|---|---|---|
| Schweinefleisch, roh | 20,95 g | 242 mg | 1,2 % |
| Hähnchenbrustfilet, roh | 21,23 g | 222 mg | 1,0 % |
| Lachs, roh | 20,42 g | 219 mg | 1,1 % |
| Hühnerei | 12,57 g | 272 mg | 2,2 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 30 mg | 0,9 % |
| Sonnenblumenkerne | 20,78 g | 451 mg | 2,2 % |
| Walnüsse | 15,23 g | 208 mg | 1,4 % |
| Weizen-Vollkornmehl | 13,70 g | 317 mg | 2,3 % |
| Mais-Vollkornmehl | 6,93 g | 125 mg | 1,8 % |
| Reis, ungeschält | 7,94 g | 96 mg | 1,2 % |
| Sojabohnen, getrocknet | 36,49 g | 655 mg | 1,8 % |
| Erbsen, getrocknet | 24,55 g | 373 mg | 1,5 % |
Cystein zählt zu den nichtessentiellen Aminosäuren. Zumindest für Erwachsene gilt es als gesichert, dass der Körper den gesamten Bedarf an Cystein auch aus der essentiellen Aminosäure Methionin synthetisieren kann, sofern die Nahrung genug davon enthält. Ob Cystein seinerseits imstande ist, einen Teil des Methionins zu ersetzen, ist noch Gegenstand der Forschung. Manchmal werden Cystein und Methionin unter dem Begriff schwefelhaltige Aminosäuren zusammengefasst und ein gemeinsamer Bedarf angegeben. Zu beachten ist, dass es sich dabei aber nicht um einen echten kombinierten Bedarf, sondern lediglich um den Methioninbedarf bei cysteinfreier Kost handelt.[15]
Oftmals werden in der Literatur und den Nährstoffdatenbanken bei der Angabe des Cysteingehaltes die Begriffe Cystein und Cystin synonym verwendet. Im strengen Sinne ist das nicht korrekt, da Cystein das Monomer und Cystin das durch eine Schwefelbrücke entstandene Dimer bezeichnet. Viele gängige Analysemethoden quantifizieren die beiden Verbindungen aber nicht getrennt.[16]
Biochemische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Vielfältige Funktionen des Cysteins im Organismus leiten sich aus der relativen Reaktivität seiner freien Thiolgruppe ab. So kann sich schon bei der Proteinfaltung eine Disulfidbrücke (–S–S–) zwischen Cysteinresten derselben Polypeptidkette ausbilden, die beim Faltungsprozess in räumliche Nähe zueinander gelangen. Die Verbrückung durch eine zusätzliche kovalente Bindung zwischen Aminosäuren an nicht benachbarten Positionen der Kette erhöht die Stabilität ihrer räumlichen Anordnung, der Tertiärstruktur. Im faltenden Proteinmolekül kann unter Wirkung von Protein-Disulfid-Isomerasen eine Disulfidbrücke, auch Cystin-Brücke genannt, eventuell auf andere Cysteinreste verlagert werden. Die über das S-Atom von Cysteinresten ausgebildeten Querbrücken spielen eine wesentliche Rolle für die Faltung des nativen Proteins und stabilisieren dessen Tertiärstruktur durch kovalente Bindungen. Stabilisierende Disulfidbrücken kommen in vielen, vornehmlich sekretorischen und extrazellulären Proteinen vor, beispielsweise im Insulin. Sie können auch in einem aus mehreren Polypeptidketten gebildeten Proteinkomplex dessen Quartärstruktur stabilisieren oder Ketten miteinander verknüpfen, etwa bei Antikörpern, sowie verknüpfte Ketten zu Bündeln verbinden, so bei Keratinen. Bei kurzen Peptiden mit Cystein am Kettenende wie dem Nonapeptid Oxytocin, einem Proteohormon, entsteht durch Ausbildung einer Disulfidbrücke eine ringförmige Struktur, was einen unspezifischen Abbau durch Peptidasen erschwert.[17]
Eine größere Gruppe von Enzymen besitzt von Cysteinresten koordinierte Eisen-Schwefel-Cluster. Die relativ reaktive Thiolgruppe des Cysteins kann aber auch direkt am katalytischen Mechanismus beteiligt sein, wie bei der Glycerinaldehyd-3-phosphat-Dehydrogenase, wo Cystein das Substrat am aktiven Zentrum bindet.[18]
Cystein ist außerdem ein Ausgangsstoff bei der Biosynthese von Verbindungen wie Glutathion, Coenzym A und Taurin.[19]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cystein liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:

Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Cystein auch seine geringste Löslichkeit in Wasser hat. Der isoelektrische Punkt von Cystein liegt bei einem pH-Wert von 5,02.[20]
Cystein könnte zu den nicht essentiellen Aminosäuren gezählt werden, da es vom Körper gebildet werden kann. Allerdings ist dazu die essentielle Aminosäure Methionin erforderlich. Daher wird Cystein üblicherweise als semi-essentiell betrachtet. Als Bestandteil vieler Proteine und Enzyme ist es oft am Katalysemechanismus beteiligt.
In neutraler bis alkalischer wässriger Lösung erfolgt bei Luftzutritt eine Oxidation zu Cystin.[5] Bei der Einwirkung stärkerer Oxidationsmittel wird die Cysteinsäure gebildet.[5]
Technische Gewinnung
[Bearbeiten | Quelltext bearbeiten]L-Cystin kann, wie fast alle anderen Aminosäuren, durch Einwirkung von Salzsäure auf Proteine wie Keratin (meist aus keratinreichen Geweben wie Menschen- oder Tierhaaren oder Federn) durch Hydrolyse gewonnen werden. Das so gewonnene L-Cystin kann dann durch elektrochemische Reduktion in L-Cystein überführt werden.
Da heute bei Verbrauchern eindeutig ein Trend weg von tierischen Produkten zu pflanzlichen Alternativen zu beobachten ist, kommt mittlerweile auch Cystein zum Einsatz, das auf Pflanzenbasis gewonnen wurde. Dies wird durch Fermentation aus Rohstoffen auf veganer Basis und anorganischen Spurenelementen hergestellt.[21]
Seit einiger Zeit ist die Darstellung auch durch Fermentation mit Bakterien, z. B. Escherichia coli, auch unter Einsatz gentechnisch veränderter Organismen möglich (siehe Darstellung Tryptophan).
Racemisches Cystein (DL-Cystein) kann vollsynthetisch aus 2-Chloracetaldehyd, Natriumhydrogensulfid, Ammoniak und Aceton über das nach der Asinger-Reaktion gewonnene Zwischenprodukt 2,2-Dimethyl-3-thiazolin synthetisiert werden. Anschließend wird Blausäure angelagert und sauer hydrolysiert.[22]
Biosynthese und Metabolismus
[Bearbeiten | Quelltext bearbeiten]Cystein wird biosynthetisch aus Serin, welches das Grundgerüst liefert, und Methionin über Homocystein, das die SH-Gruppe beiträgt, in der Leber gebildet. Dazu sind die Enzyme Cystathionin-Synthetase und Cystathionase erforderlich. Serin- oder Methioninmangel hemmen folglich die Cysteinsynthese.
Die Aminosäure kann durch α,β-Eliminierung abgebaut werden. Dabei entstehen Aminoacrylat und Schwefelwasserstoff (H2S). H2S wird zum Sulfat (SO42−) oxidiert. Aminoacrylat isomerisiert zum Iminopropionat, das hydrolytisch seine Aminogruppe abspaltet und so zum Pyruvat wird.
Durch Transaminierung kann es auch zum β-Mercaptopyruvat werden. Die Sulfit-Transferase überträgt Sulfit auf die Thiolgruppe und wandelt diese dadurch in ein Thiosulfat um. Nach Hydrolyse der Kohlenstoff-Schwefel-Bindung wird anschließend Pyruvat frei; das Thiosulfat (S2O32−) wird zum Sulfat oxidiert. Cystein kann auch an der SH-Gruppe oxidiert werden und anschließend zum Taurin decarboxylieren.
Durch genetisch bedingte Defekte im Cystintransporter kann nach Aufnahme im Magen-Darm-Trakt und Wiederaufnahme in der Niere eine Cystinurie entstehen. Die Mutation im rBAT-Gen betrifft auch den Stoffwechsel der Aminosäuren Lysin, Arginin und Ornithin, also die Polyamino-Aminosäuren.
Therapeutische Funktionen
[Bearbeiten | Quelltext bearbeiten]Aus L-Cystein werden pharmazeutische Wirkstoffe im industriellen Maßstab hergestellt, z. B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein (NAC). Diese beiden Pharmawirkstoffe sollen als orale Mukolytika den oft zähen Bronchialschleim bei chronischer Bronchitis und chronisch obstruktiver Lungenerkrankung verflüssigen. Unter der Gabe von Cystein wird der im Verlauf dieser Erkrankungen vermehrt gebildete Bronchialschleim dünnflüssiger und kann so leichter abgehustet werden. Cystein steigert auch eine Reihe von Lymphozytenfunktionen, wie beispielsweise die zytotoxische T-Zellaktivität. Cystein und Glutathion verhindern die Expression von NF-AT, des nukleären Transkriptionsfaktors in stimulierten T-Zell-Linien. In-vitro-Studien zeigen, dass die stimulierende Wirkung von TNF (Tumornekrosefaktor), induziert durch freie Radikale, auf die HIV-Replikation in Monozyten durch schwefelhaltige Antioxidantien gehemmt werden kann. Diese grundlegenden Studien sprechen dafür, dass die Behandlung von Entzündungskrankheiten und AIDS mit Cystein damit möglicherweise nützlich sein könnten.
Cystein kann Schwermetall-Ionen komplexieren. Es wird daher unter anderem als Therapeutikum für Silber-Vergiftungen eingesetzt. Da es freie Radikale an die Thiolgruppe bindet, wird Cystein auch zur Vorbeugung gegen Strahlenschäden eingesetzt. Bei Föten, Früh- und Neugeborenen, sowie bei Leberzirrhose ist die Aktivität des Enzyms Cystathionase nicht vorhanden oder stark eingeschränkt. In diesen Fällen ist eine exogene Cysteinzufuhr notwendig.[23] Es ist ein Radikalfänger, der die zellschädigenden Stoffe unschädlich macht und für den in neueren Studien eine gewisse Vorbeugefunktion gegen neurodegenerative Erkrankungen postuliert wird.
Bei der sehr seltenen Pantothenatkinase-assoziierten Neurodegeneration (PKAN), einer Variante der Neurodegeneration mit Eisenablagerung im Gehirn (NBIA), bewirkt eine Mutation im für das Enzym Pantothenatkinase codierende PANK2-Gen, dass es zu einer Anreicherung von Cystein-Eisen-Komplexen im Gehirn – speziell im Globus pallidus und der Pars reticulata der Substantia nigra – kommt. Dies führt wiederum zu einem Anstieg freier Radikale und letztlich zu einer oxidativen Schädigung der Nervenzellen des Gehirns.[24]
Cystein ist Bestandteil von Aminosäure-Infusionslösungen zur parenteralen Ernährung.[25]
Lebensmittelzusatzstoff
[Bearbeiten | Quelltext bearbeiten]L-Cystein wird in Form des Hydrochlorids als Mehlbehandlungsmittel und Backmittel bei der Herstellung von Backwaren verwendet. Es weicht den Kleber auf, indem es die Moleküle der Gluteninfraktion durch Thiol-Disulfidaustausch mit den intermolekularen Disulfidbindungen depolymerisiert (das heißt die Verbindungen aufbricht, welche die langen Kettenmoleküle zusammenhalten).[21] Infolgedessen wird der Teig elastischer und entwickelt sich schneller. Bei kleberstarkem Mehl lässt sich ein höheres Gebäckvolumen erzielen, weil das Treibgas (wie etwa das durch die Hefe gebildete Kohlendioxid) den Teig leichter lockern kann.[26] Auch bei der Herstellung von Teigwaren kann Cysteinhydrochlorid zugesetzt werden, um die Teigherstellung zu beschleunigen (ein Zusatz von 0,01 % verkürzt die Misch- bzw. Knetzeit um 15–20 %). Es hemmt die Bildung von Melanoidinen bei der nichtenzymatschen Bräunung und wirkt damit Verfärbungen entgegen.[26] Neben diesen Anwendungen wirkt Cystein, wie andere Aminosäuren, als Geschmacksstoff, Geschmacksverstärker und Nährstoff.[27]
L-Cysteinhydrochlorid bzw. Hydrochloridmonohydrat ist nach europäischem Lebensmittelrecht als Zusatzstoff ohne Höchstmengenbeschränkung (quantum satis) unter der Nummer E 920 zugelassen.[28][29] Grundsätzlich ist es deklarationspflichtig, jedoch nicht, wenn es im gekennzeichneten Produkt nicht mehr technologisch wirksam ist gemäß Artikel 20 der Lebensmittel-Informationsverordnung und § 9 Abs. 8 Nr. 1 der Zusatzstoff-Zulassungsverordnung. Nach Auffassung des Backmittelinstituts (einer Einrichtung des Backzutatenverbands) erstreckt sich die technologische Wirksamkeit von Cystein, das als Mehlbehandlungsmittel eingesetzt wird (also bereits vor dem Anteigen dem Mehl zugesetzt wurde), nicht auf die fertige Backware, aber auf den Teigling, wenn dieser beispielsweise als Halbfertigerzeugnis angeboten wird.[30] Bei fertigen Backwaren braucht es demzufolge nicht gekennzeichnet zu werden. Der Verbraucherzentrale-Bundesverband teilt diese Rechtsauffassung nicht.[31]
Weitere Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]In japanischen Friseursalons ersetzt Cystein, das Disulfidbindungen im Keratin aufzubrechen vermag, die in Europa übliche, streng riechende Thioglycolsäure, wenn es darum geht, Haare für Dauerwellen zu präparieren. Auch in anderen Kosmetikprodukten wird Cystein verwendet.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu E 920: L-cysteine in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- ↑ Eintrag zu CYSTEINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- ↑ a b c d Datenblatt (R)-(+)-Cystein bei Merck, abgerufen am 23. März 2011.
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of Amino Acids, S. 7-1.
- ↑ a b c Eintrag zu L-Cystein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juli 2011.
- ↑ a b Eintrag zu Cystein in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- ↑ William Hyde Wollaston: On Cystic Oxide, a New Species of Urinary Calculus. In: Phil. Trans. Royal. Soc. Band 100, 1810, S. 223 ff. (englisch).
- ↑ Sabine Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. ( vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- ↑ Eugen Baumann: Über Cystin und Cystein. In: Zeitschrift für Physiologische Chemie. Band 8, Nr. 4, 1884, S. 299 ff.
- ↑ Emil Fischer, K. Raske: Umwandlung des l-Serins in aktives natürliches Cystin. In: Berichte der Deutschen Chemischen Gesellschaft. Band 41, Nr. 1, 1908, S. 893 ff.
- ↑ Abby Thompson, Mike Boland, Harjinder Singh: Milk Proteins: From Expression to Food. Academic Press, 2009, ISBN 978-0-08-092068-9, S. 492 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David Plackett: Biopolymers: New Materials for Sustainable Films and Coatings. Wiley, 2011, ISBN 978-1-119-99432-9, S. 115 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- ↑ Ronald O. Ball, Glenda Courtney-Martin, Paul B. Pencharz: The in vivo sparing of methionine by cysteine in sulfur amino acid requirements in animal models and adult humans. In: The Journal of Nutrition. Band 136, 6 Suppl, Juni 2006, S. 1682S–1693S, PMID 16702340 (englisch).
- ↑ M. Aristoy, F. Toldra: Amino Acids. In: L. M. L. Nollet (Hrsg.): Handbook of Food Analysis. 2. Auflage. Marcel Dekker AG, New York/Basel 2004, ISBN 0-8247-5036-5, S. 95, 110 (englisch).
- ↑ Peter Heinrich, Matthias Müller, Lutz Graeve (Hrsg.): Löffler/Petrides Biochemie und Pathobiochemie. 9. Auflage, Springer-Verlag, Heidelberg 2014, ISBN 978-3-642-17971-6, S. 485.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007, ISBN 978-3-8274-1800-5, S. 38f, 48, 494 f, 570.
- ↑ D. Doenecke, J. Koolman, G. Fuchs, W. Gerok: Karlsons Biochemie und Pathobiochemie. Hrsg.: Peter Karlson, Detlef Doenecke. 15., komplett überarb. und neugestalte Auflage. Thieme, Stuttgart 2005, ISBN 3-13-357815-4, S. 41, 208, 219.
- ↑ P. M. Hardy: The Protein Amino Acids. In: G. C. Barrett (Hrsg.): Chemistry and biochemistry of the amino acids. Chapman and Hall, London/New York 1985, ISBN 0-412-23410-6, S. 9 (englisch).
- ↑ a b Plant-Based L-Cysteine for Dough Softening. wacker.com, abgerufen am 8. August 2020 (englisch).
- ↑ Jürgen Martens, Heribert Offermanns, Paul Scherberich: Eine einfache Synthese von racemischem Cystein. In: Angewandte Chemie. Band 93, 1981, S. 680, doi:10.1002/ange.19810930808; Angewandte Chemie International Edition. English, Band 20, 1981, S. 668, doi:10.1002/anie.198106681.
- ↑ P. Fürst, H.-K. Biesalki u. a.: Ernährungsmedizin. Hrsg.: Hans-Konrad Biesalski, Olaf Adam. 3., erw. Auflage. Thieme, Stuttgart 2004, ISBN 3-13-100293-X, S. 94.
- ↑ B. Zhou, S. K. Westaway, B. Levinson, M. A. Johnson, J. Gitschier, S. J. Hayflick: A novel pantothenate kinase gene (PANK2) is defective in Hallervorden-Spatz syndrome. In: Nature Genetics. Band 28, Nr. 4, August 2001, S. 345–349, doi:10.1038/ng572, PMID 11479594 (englisch).
- ↑ Siegfried Ebel, Hermann J. Roth (Hrsg.): Lexikon der Pharmazie. Thieme, Stuttgart 1987, ISBN 3-13-672201-9, S. 66.
- ↑ a b Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6. vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg 2008, ISBN 978-3-540-73201-3, doi:10.1007/978-3-540-73202-0.
- ↑ Peter Kuhnert: Lexikon Lebensmittelzusatzstoffe. 4., vollständig überarbeitete Auflage. Behr, Hamburg 2014, ISBN 978-3-95468-118-1.
- ↑ Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 9. Februar 2016
- ↑ Verordnung (EU) Nr. 231/2012 in der konsolidierten Fassung vom 20. Oktober 2015
- ↑ Martina Bröcker, Amin Werner: Die technologische Wirksamkeit von Lebensmittelzusatzstoffen in Brot, Kleingebäck, Feinen Backwaren und Teiglingen. In: bmi aktuell. Dezember 2007 (wissensforum-backwaren.de [PDF; 134 kB]). Die technologische Wirksamkeit von Lebensmittelzusatzstoffen in Brot, Kleingebäck, Feinen Backwaren und Teiglingen ( vom 6. April 2016 im Internet Archive)
- ↑ Mehlbehandlungsmittel. Verbraucherzentrale Bundesverband e. V., archiviert vom (nicht mehr online verfügbar) am 6. April 2016; abgerufen am 7. April 2016.