Lanthanoide
|
Lage im Periodensystem
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lanthanoide [] („Lanthanähnliche“; griech.: Endung -ειδἠς (-eides) „ähnlich“) ist eine Gruppenbezeichnung ähnlicher Elemente. Zugerechnet werden ihr das Lanthan und die 14 im Periodensystem folgenden Elemente Cer, Praseodym, Neodym, Promethium, Samarium, Europium, Gadolinium, Terbium, Dysprosium, Holmium, Erbium, Thulium, Ytterbium und Lutetium. Im Sinne des Begriffs gehört Lanthan nicht zu den Lanthanähnlichen. Hier folgt die Nomenklatur der IUPAC aber dem praktischen Gebrauch. Die Verwendung der alten Bezeichnung Lanthanide ist weiterhin erlaubt.[1][2] Alle Lanthanoide sind Metalle und werden auch als Elemente der Lanthanreihe bezeichnet. Sie sind ein Teil der Gruppe der Metalle der Seltenen Erden.
| 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |

Vorkommen
[Bearbeiten | Quelltext bearbeiten]Die Lanthanoide werden auch als Metalle der seltenen Erden bezeichnet. Dieser Name ist aber insofern verwirrend, als die Elemente dieser Gruppe mit Ausnahme des instabilen Promethiums keineswegs so selten sind, wie es suggeriert wird. So ist beispielsweise Cer in der Natur häufiger als die Elemente Arsen oder Blei. Am Aufbau der Erdkruste sind sie zu einem Massenanteil von 0,02 % beteiligt. Es handelt sich um insgesamt 15 Elemente der 6. Periode, von denen die 14 auf Lanthan folgenden Elemente als Untergruppe der 3. Nebengruppe aufgefasst werden können.
Aufgrund ihrer chemischen Ähnlichkeit kommen die Lanthanoide in der Natur meist vergesellschaftet vor. Da die Trennung der einzelnen Lanthanoide schwierig ist und ihre chemischen Eigenschaften sehr ähnlich sind, werden diese Elemente oft unter dem (nicht offiziellen) chemischen Symbol Ln (nicht zu verwechseln mit La für Lanthan) zusammengefasst. Viele von ihnen können aus Monazit (auch als sekundäre Ablagerungen – Monazitsande) gewonnen werden. Die häufigsten und ökonomisch wichtigsten lanthanoidführenden Minerale sind:[3]
- Monazit CePO4
- Xenotim YPO4
- Bastnäsit LnCO3F
- Parisit CaLn2(CO3)3F2
- Allanit CaLn(Al,Fe2+)3Si3O11OH
- Synchysit CaLn(CO3)2F
- Ankylit-(Ce) SrCe(CO3)2(OH) · H2O
- Ankylit-(La) Sr(La,Ce)[OH|(CO3)2] · H2O
- Cerianit CeO2
- Ln bezeichnet in den Formeln alle Elemente von Lanthan bis Lutetium sowie das sehr ähnliche Yttrium (Y).
In fast allen Mineralen findet man eine Häufung entweder der leichten (Ce) oder der schweren Lanthanoide (Y verhält sich mineralchemisch wie ein schweres Lanthanoid). So enthält beispielsweise Monazit überwiegend Ce und La, während der Gehalt der nachfolgenden Lanthanoide mit der Ordnungszahl abnimmt (daher wird die Formel von Monazit auch immer als CePO4 angegeben). In Xenotim findet man genau den umgekehrten Fall (daher auch YPO4). Diese meist sehr effektive Fraktionierung hat ihre Ursache in der Lanthanoiden-Kontraktion und den von Mineral zu Mineral unterschiedlich großen zur Verfügung stehenden Kristallgitterplätzen. Auch andere Mineralgruppen können bisweilen hohe Anteile an Lanthanoiden in ihre Struktur einbauen (z. B. Zirkon, Granat). Weiterhin kommen die Lanthanoide auf dem Mond in Form der sog. KREEP-Erze vor.
In abgebranntem Kernbrennstoff sind Lanthanoide in nennenswerten Mengen vorhanden, da einige von ihnen häufige Spaltprodukte sind. Bei der Wiederaufarbeitung ist die chemische Ähnlichkeit von Actinoiden (wie Uran, Plutonium, Neptunium …) und Lanthanoiden störend. Da viele Lanthanoid-Nuklide starke Neutronengifte sind, müssen diese vor Wiederverwendung des Brennstoffs möglichst „sauber“ abgetrennt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]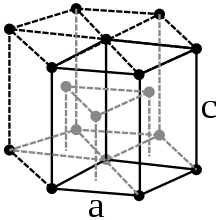
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Lanthanoide sind silbrig-glänzende, relativ weiche und reaktionsfähige Metalle. Fast alle weisen die für Metalle typische dichteste Kugelpackung auf. Die Härte nimmt mit steigender Ordnungszahl zu.
Die Lanthanoide gehören wie die Actinoide zu den inneren Übergangselementen oder f-Block-Elementen, da in diesen Reihen die f-Orbitale nicht vollständig mit Elektronen gefüllt sind.
Die Promethium-Isotope sind alle instabil, also radioaktiv.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Aufgrund der ähnlichen Struktur der Valenzschale verhalten sich die Lanthanoide chemisch wie die Elemente der 3. Gruppe des Periodensystems Scandium und Yttrium und bilden mit diesen zusammen die Gruppe der Seltenen Erden. An der Luft oxidieren sie schnell und werden matt. Mit Wasser reagieren sie mehr oder weniger schnell unter Bildung von Wasserstoff.
Beginnend bei Cer wird das 4f-Orbital nach und nach aufgefüllt. Es ist bei Lutetium schließlich mit 14 Elektronen vollständig besetzt. Da die 4f-Orbitale tief im Innern der Atome liegen, nehmen sie im Gegensatz zu den d-Orbitalen der übrigen Nebengruppenelemente wenig Einfluss auf das chemische Verhalten. Die Lanthanoiden-Elemente sind sich somit in ihren chemischen Eigenschaften relativ ähnlich. Sie gleichen sich so sehr, dass man sie bei der Entdeckung der Yttererde 1794 sogar für das Oxid ein und desselben Elements hielt. Das Gleiche gilt für die zahlreichen Bestandteile der Ceriterde. Gemeinsam ist ihnen die Oxidationszahl +3. Daneben treten bei einigen Elementen noch die Oxidationszahlen +2 und +4 auf.
Als Gadolinium Break wird bei den Lanthanoiden eine Unstetigkeit im Verlauf der Ionenradien zwischen Gadolinium und Terbium bezeichnet. Dieser erklärt, warum sich trotz der Ähnlichkeit der Lanthanoide das chemische Verhalten der Elemente nach dem Gadolinium ändert. Das chemische Verhalten lässt sich am Gadolinium Break leicht beeinflussen. So reichen Spuren von Americium, damit ein Terbiumkomplex den Strukturtyp der leichteren Lanthanoide annimmt.[4]
Farben der Lanthanoid-Ionen in wässriger Lösung
[Bearbeiten | Quelltext bearbeiten]| Oxidations- zahl[5][6] |
57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +2 | Sm2+ blutrot |
Eu2+ farblos |
Tm2+ violettrot |
Yb2+ gelbgrün |
|||||||||||
| +3 | La3+ farblos |
Ce3+ farblos |
Pr3+ gelbgrün |
Nd3+ violett |
Pm3+ violettrosa |
Sm3+ tiefgelb |
Eu3+ farblos |
Gd3+ farblos |
Tb3+ farblos |
Dy3+ gelbgrün |
Ho3+ gelb |
Er3+ tiefrosa |
Tm3+ blassgrün |
Yb3+ farblos |
Lu3+ farblos |
| +4 | Ce4+ orangegelb |
Pr4+ gelb |
Nd4+ blauviolett |
Tb4+ rotbraun |
Dy4+ orangegelb |
||||||||||
Lanthanoiden-Kontraktion
[Bearbeiten | Quelltext bearbeiten]Aufgrund der Lanthanoiden-Kontraktion nimmt der Atomradius innerhalb der Reihe von Cer (183 pm) bis Lutetium (172 pm) nahezu stetig ab (Ausnahmen sind Europium und Ytterbium). Dies liegt daran, dass die Elemente, die – von der Ordnungszahl ausgehend – vor den Lanthanoiden liegen, bereits die 6s- und 5p-Schale mit Elektronen aufgefüllt haben, jedoch die 4f-Schale nicht. Die Lanthanoide füllen nun die 4f-Schale mit Elektronen auf. Bei einer vereinfachten Vorstellung des Atom als aus räumlich abgetrennten Elektronenschalen bestehend, füllt sich nun eine, räumlich gesehen, näher zum Kern befindliche Elektronenschale mit Ladungsträgern. Nebenbei füllt sich der Kern selbstverständlich mit der gleichen Anzahl Protonen, wie Elektronen auf die 4f-Schale hinzukommen. Durch die dadurch bedingte stärkere Anziehung zwischen Elektronen und Protonen schrumpft der Atomradius, während die Ordnungszahl steigt.
Dieser Effekt ist eigentlich nicht außergewöhnlich, da beim Auffüllen einer Schale innerhalb einer Periode immer der Radius sinkt. Allerdings ergeben sich aus dieser Eigenschaft einige Konsequenzen:[7]
- Aufgrund der abnehmenden Größe ist eine Trennung mittels Ionenaustauschern leicht möglich.[Anm 1]
- Beim Holmium ist der Radius der Ln3+ so klein, dass er fast dem des Y3+ entspricht; deshalb findet man Yttrium meist mit den „Schwererden“ zusammen
- Innerhalb einer Gruppe haben die Übergangselemente an 2. und 3. Stelle sehr ähnliche Eigenschaften.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Es gibt zahlreiche Beispiele für die Verwendung der Lanthanoide:[7]
- Cer: ist Hauptbestandteil im Auermetall, das als „Feuerstein“ von Feuerzeugen verwendet wird, ebenso als Oxid in selbstreinigenden Öfen und als Katalysator beim Cracken.
- Praseodym: befindet sich in gelb gefärbtem Glas, z. B. in Schweißerschutzbrillen.
- Neodym: wird hauptsächlich für starke Magnete (Neodym-Eisen-Bor) verwendet. Ist ebenfalls Bestandteil der Schweißerschutzbrillengläser und wird in Feststofflasern an Stelle von Rubinen eingesetzt.
- Promethium: dient als Wärme- bzw. Energiequelle in (unbemannten) Satelliten und Raumsonden.
- Samarium: findet als Permanentmagnet Anwendung, z. B. in Kopfhörern.
- Europium: dient als Neutronenabsorber in Kernspaltungsreaktoren, aber auch als Aktivator der roten Leuchtstoffe in der Fernsehröhre.
- Gadolinium: findet man auch in der Fernsehröhre als Aktivator der grünen Leuchtstoffe.
- Terbium: wird als Lasermaterial eingesetzt.
- Dysprosium: ist als Neutronenabsorber in Kernreaktoren zu finden.
- Holmium: ist nur in Legierungen anzutreffen. Allgemein sind die Lanthanoide häufig in Legierungen anzutreffen, sie machen Stahl leichter verarbeitbar.
- Erbium: ist in fotografischen Filtern enthalten.
- Thulium: dient auch in Kernkraftwerken als Neutronenabsorber.
- Ytterbium: erzeugt Röntgenstrahlen ohne Elektrizität, z. B. in tragbaren Röntgenapparaten.
- Lutetium: ist ein Katalysator beim Cracken und Polymerisieren.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Vor der Einführung von Ionenaustauschern konnte man nur bei Cer (drei- und vierwertig) oder Europium (zwei- und dreiwertig) verschiedene Wertigkeitsstufen ausnutzen, bei den anderen Elementen musste man zur Trennung hunderte Male umkristallisieren.
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1928–1947.
- James E. Huheey: Anorganische Chemie, 1. Auflage, de Gruyter, Berlin 1988, ISBN 3-11-008163-6, S. 873–900.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1571–1600.
- dtv-Atlas zur Chemie 1981, Teil 1, S. 216–221.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Literatur von und über Lanthanoide im Katalog der Deutschen Nationalbibliothek
- W. Thum: Die Entdeckung der Seltenerdmetalle. Eine unter didaktischen Gesichtspunkten erstellte Zusammenfassung für den Unterricht. chemie-master.de
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, Berlin 1999, ISBN 3-540-63097-X.
- ↑ Nomenclature of Inorganic Chemistry, IUPAC Recommendations 2005.
- ↑ A. M. Mariano: Economic geology of rare earth minerals. In: B. R. Lipin, G. A. McKay (Hrsg.): Reviews in Mineralogy, Vol. 21 – Geochemistry and mineralogy of rare earth elements (1989). Herausgegeben von der “Mineralogical Society of America”, ISBN 0-939950-25-1, S. 309–337.
- ↑ Georg Steinhauser: Strukturchemie - Ein Hauch von Nichts. In: Nachrichten aus der Chemie. 66, 2018, S. 118, doi:10.1002/nadc.20184067855.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1937.
- ↑ dtv-Atlas zur Chemie. 1981, Teil 1, S. 220.
- ↑ a b Lanthanoide-Vortragsskript der Uni Bayreuth.