Thymus
Der Thymus (latinisiert von altgriechisch θυμός Thymos, deutsch ‚Lebenskraft, Erregung‘), oft auch die Thymusdrüse oder das Bries genannt, ist eine Drüse des lymphatischen Systems von Wirbeltieren und somit Teil des Immunsystems. Das Organ befindet sich bei Säugetieren kopfwärts (kranial) des Herzens im Mittelfell hinter dem Brustbein. Bei einigen Säugetieren (z. B. Paarhufer, Meerschweinchen) erstreckt es sich über den gesamten Hals, bei Vögeln ist es ausschließlich im Halsbereich ausgebildet. Mit dem Eintritt in die Geschlechtsreife bildet sich das Organ physiologisch zurück (Involution).
Der Thymus ist ein lymphatisches Organ und vor allem während der Kindheit an der Ausbildung der spezifischen Immunabwehr maßgeblich beteiligt, insbesondere für die T-Lymphozyten. Die volkstümliche Bezeichnung „Wachstumsdrüse“ ist dahingehend berechtigt, da das Organ nur in der Phase des heranwachsenden Organismus auftritt. Mit dem Körperwachstum an sich ist es jedoch nicht assoziiert.
Aufbau und Funktion
[Bearbeiten | Quelltext bearbeiten]

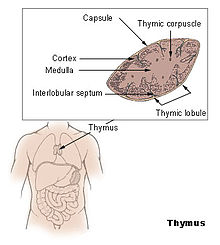
Der Thymus des Menschen ist ein zweilappiges Organ, wobei bei Neugeborenen jeder Lappen ca. 6 cm lang und 2 cm breit ist. Im Kleinkindalter wächst der Thymus noch etwas, bis zur Pubertät behält er seine Größe, danach wird sein Gewebe mehr und mehr durch funktionsloses Fettgewebe ersetzt (→ Involution). Bei den übrigen Säugetieren unterscheidet man einen paarigen Halslappen (Lobus cervicalis), einen Übergangsteil (Isthmus) und einen unpaarigen Brustlappen (Lobus thoracicus). Bei Vögeln sind beidseits entlang des Halses mehrere kleine Thymuslappen ausgebildet.
Im Gegensatz zu den übrigen lymphatischen Organen, die ausschließlich aus dem Mesoderm hervorgehen, entwickelt sich der Thymus aus dem Meso-, dem Ento- und dem Ektoderm und wird daher als lymphoepitheliales Organ bezeichnet. Histologisch lassen sich im Thymus Läppchen (Lobuli thymici) mit Rinde und Mark unterscheiden. Besonders im Thymusmark befinden sich beim Menschen und den meisten anderen Wirbeltieren die für das lymphatische Gewebe des Thymus typischen Hassall-Körperchen.
Im Thymus werden Thymozyten (Prä-T-Lymphozyten) in T-Lymphozyten (verkürzt auch T-Zellen genannt) umgewandelt. Die Vorläufer der T-Lymphozyten, multipotente Stammzellen, wandern aus dem Knochenmark über die Blutbahn in die Läppchenrinde ein. Danach durchlaufen sie das Läppchen bis in die Markregion und machen dabei eine Reifung durch, die man Prägung nennt. Sie läuft in drei Schritten ab und endet mit dem Erreichen der Immunkompetenz:
Zunächst entstehen durch zufällige Rekombination Lymphozyten gegen alle möglichen Zielmoleküle. Eine Blut-Thymus-Schranke verhindert den Kontakt zu körperfremden Antigenen. Diejenigen Klone von Lymphozyten, die körpereigene MHC-Moleküle erkennen können und damit funktionstüchtig sind, werden vermehrt. Alle anderen Klone werden in den programmierten Zelltod geschickt (positive Selektion). Das Erkennen der körpereigenen MHC-Moleküle in Kombination mit körperfremden Antigenen löst später die spezifische Immunabwehr aus. In einem zweiten Schritt werden jene T-Lymphozyten, die gegen körpereigene Antigene gerichtet sind und deshalb körpereigene Zellen attackieren würden, ebenfalls durch programmierten Zelltod aussortiert (negative Selektion). Insgesamt werden über 90 Prozent der Lymphozyten während des Prägungsprozesses wieder eliminiert. Die übriggebliebenen T-Zellen verfügen nunmehr über eine zuverlässige Fähigkeit zum Unterscheiden zwischen „Selbst“, also körpereigenem Gewebe, und „Nicht-Selbst“, dies anhand der jeweiligen Oberflächenstrukturen.[1] Diese Fähigkeit nennt man Selbsttoleranz. Sie führt dazu, dass körpereigenes Gewebe nicht angegriffen wird. Vom Thymus wandern die nunmehr ausdifferenzierten T-Lymphozyten über das Blut in die sekundären lymphatischen Organe, wo sie sich bei Bedarf, das heißt, wenn ein entsprechendes Antigen in den Körper eingedrungen ist, vermehren.
Allergien oder Autoimmunerkrankungen, bei denen dieses Freund-Feind-Erkennungssystem nicht zuverlässig funktioniert, sind regelmäßig ursächlich mit falsch funktionierenden T-Zellen verknüpft.[2]
Da der Thymus der Primärentwicklung der T-Lymphozyten dient, wird er zusammen mit dem Bursa-äquivalenten Organ als primäres oder zentrales lymphatisches Organ bezeichnet.
Involution
[Bearbeiten | Quelltext bearbeiten]
Nach der Ausbildung eines umfangreichen Reservoirs an gegen spezifische Antigene gerichteten T-Lymphozyten ist der Thymus nicht mehr notwendig. Nun erfolgt die Vermehrung der einzelnen T-Lymphozyten-Klone, falls entsprechende Antigene in den Körper gelangen, in den T-Lymphozyten-Regionen der sekundären lymphatischen Organe (z. B. Paracortex im Lymphknoten, PALS der Milz). Mit Einsetzen der Pubertät bildet sich der Thymus zurück (Involution), so dass bei Erwachsenen nur noch ein Thymusrestkörper übrig bleibt, beim Menschen auch als retrosternaler Fettkörper bezeichnet, der hauptsächlich aus Fettgewebe besteht.
Die vollständige Rückbildung des Thymus ist ein wesentlicher Faktor für die Immunoseneszenz.[3]
Fehlender Thymus
[Bearbeiten | Quelltext bearbeiten]Bei der extrem seltenen retikulären Dysgenesie ist angeboren kein Thymusgewebe nachweisbar. Damit einher geht das Fehlen jeglicher Immunfunktion.[4] (Vergleiche auch Thymusaplastische Maus)
Thymektomie
[Bearbeiten | Quelltext bearbeiten]Eine Entfernung des Thymus (Thymektomie) bei Föten oder sehr jungen Tieren oder Menschen führt dazu, dass kein funktionierendes Immunsystem aufgebaut werden kann, denn T-Lymphozyten spielen darin eine zentrale Rolle. Indikationen für eine Thymektomie beim erwachsenen Patienten sind unter anderem ein Thymom sowie Myasthenia gravis, bei der eine Entfernung des Thymus unter bestimmten Voraussetzungen den Krankheitsverlauf positiv beeinflussen kann.
Im Jahr 2023 berichtete das New England Journal of Medicine (NEJM), dass Erwachsene nach Entfernung des Thymus (z. B. während Thoraxchirurge wie Herzoperationen oder Tumorresektionen) ein deutlich erhöhtes Sterberisiko hätten. Zu dem Bericht haben Forscher der Harvard University sowie des Massachusetts General Hospital beigetragen.[5]
Thymuspeptide
[Bearbeiten | Quelltext bearbeiten]Aus dem Thymus können verschiedene Peptide isoliert werden wie Thymomodulin, Thymostimulin (TP-1), Thymopentin (TP-5), Thymus-Serum-Faktor (thymic humoral factor, THF) und Thymosine (z. B. Thymosin α1, Thymosin β4).
Einige Peptide werden zurzeit als Wirkstoffe auf ihre Heilwirkung untersucht. Andere, wie beispielsweise das Thymosin α1, sind mittlerweile in vielen Ländern der Welt als Arzneimittelwirkstoff zugelassen und befinden sich in der therapeutischen Anwendung. Eine Metastudie zeigte, dass Tumortherapien mit Thymuspeptiden kaum positive Effekte auf den Krankheitsverlauf zeigen, lediglich für Thymosin α1 zeigten sich im Trend verlängerte Überlebensraten.[6]
Thymus als Lebensmittel
[Bearbeiten | Quelltext bearbeiten]Der Thymus des Kalbs und des Lamms wird unter dem Namen Kalbsbries oder Milken (schweizerisch) beziehungsweise Lammbries als Spezialität angeboten.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Uwe Gille: Herz-Kreislauf- und Abwehrsystem, Angiologia. In: Franz-Viktor Salomon u. a. (Hrsg.): Anatomie für die Tiermedizin. 2. Auflage. Enke-Verlag, Stuttgart 2008, ISBN 978-3-8304-1075-1, S. 404–463.
- D. D. Taub, D. L. Longo: Insights into thymic aging and regeneration. In: Immunological Reviews. Band 205, Juni 2005, S. 72–93, ISSN 0105-2896. doi:10.1111/j.0105-2896.2005.00275.x. PMID 15882346. (Review).
- Klaus Hans Bayer: „Die Zelltherapie“, (unter besonderer Berücksichtigung des Thymus). 4. Auflage. Ultrus-Verlag, Freiburg im Breisgau 2011, ISBN 978-3-927059-82-5.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Manuela Mai: Thymus: Aufbau, Funktion, Lage und Thymuserkrankungen. In: Netdoktor. 12. Juli 2016, abgerufen am 6. Januar 2022.
- ↑ Stefanie Eyerich: Lymphozytensubpopulationen in der Allergie. In: Trillium Immunologie. Trillium GmbH Medizinischer Fachverlag, 2018, abgerufen am 6. Januar 2022.
- ↑ Donald B. Palmer: The Effect of Age on Thymic Function. In: Frontiers in Immunology. 4, 2013, S. , doi:10.3389/fimmu.2013.00316.
- ↑ Eintrag zu Retikuläre Dysgenesie. In: Orphanet (Datenbank für seltene Krankheiten)
- ↑ Kameron A. Kooshesh, Brody H. Foy, David B. Sykes, Karin Gustafsson, David T. Scadden: Health Consequences of Thymus Removal in Adults. In: New England Journal of Medicine. Band 389, Nr. 5, 3. August 2023, ISSN 0028-4793, S. 406–417, doi:10.1056/NEJMoa2302892, PMID 37530823, PMC 10557034 (freier Volltext) – (nejm.org [abgerufen am 7. November 2023]).
- ↑ E. Wolf u. a.: Thymic peptides for treatment of cancer patients. In: Cochrane Database Syst Rev. 2011 Feb 16;(2):CD003993. PMID 21328265