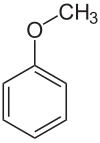
Anisol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Anisol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 108,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
154 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,516 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Anisol ist eine charakteristisch riechende, farblose, entzündliche Flüssigkeit. Da Anisol formal als Ether aus Phenol und Methanol aufgefasst werden kann, bezeichnet man es auch als Methylphenylether oder Methoxybenzol.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Die Produktion von Anisol erfolgt durch die Veretherung von Phenol bzw. Phenolaten mit Dimethylsulfat oder Methylchlorid (Ethersynthese nach Williamson)[6]:
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Anisol ist ein eukaryotischer Metabolit, der bei einer Stoffwechselreaktion im Reich der Blütenpflanzen, Koniferen und anderen Gymnospermen, gebildet wird.[7] Viele dieser Pflanzen sind für ihre Duftstoffe bekannt z. B.[8][9][10]: Orchideen (Aerangis appendiculata, Aeranthes grandiflora, Bollea coelestis, Brassavola digbyana, Brassia verucosa, Cattleya lawrenceana, Dendrobium chrysotoxum, Dracula chestertonii, Encyclia fragrans, Epidendrum lacertinum, Liparis viridiflora, Masdevallia glandulosa, Nigritella nigra), Französischer Estragon (Artemisia dracumculus var.), Wildtulpe (Tulipa turkestanica), Neotropische Palmengattung (Asterogyne martiana), Weißer Ingwer („white ginger lily“), Kobushi-Magnolie, Rote Mangrove (Rhizophora mangle), Riesenbovist (Calvatia gigantea), Himbeere (Rubus idaeus), China-Rose (Rosa chinensis), Eidechsenwurz (Sauromatum guttatum), Kopfiger Thymian (Thymus capitatus).
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Anisol ist eine angenehm riechende, farblose Flüssigkeit[3], die bei Normaldruck bei 154 °C siedet.[11] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,17726, B = 1489,756 und C = −69,607 im Temperaturbereich von 383,03 bis 437,26 K.[12] Der Schmelzpunkt der Verbindung liegt bei −37 °C.[13]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−120,0 kJ·mol−1[14] −76,69 kJ·mol−1[14] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3778 kJ·mol−1[14] | |
| Wärmekapazität | cp | 199,0 J·mol−1·K−1 (25 °C)[15] 1,84 J·g−1·K−1 (25 °C)[15] 176,98 J·mol−1·K−1 (160 °C)[16] 1,64 J·g−1·K−1 (160 °C)[16] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 646,1 K[17] | |
| Kritischer Druck | pc | 42,22 bar[17] | |
| Kritische Dichte | ρc | 2,93 mol·l−1[17] | |
| Schmelzenthalpie | ΔfH | 12,89 kJ·mol−1[18] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 38,97 kJ·mol−1[19] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 63,45 kJ/mol, β = 0,2787 und Tc = 644,1 K im Temperaturbereich zwischen 298 K und 427 K beschreiben.[19]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]In Gegenwart von Luftsauerstoff, insbesondere bei der Lagerung neigt die Verbindung zur Bildung von Peroxiden.[2] In Gegenwart von starken Säuren, wie Iodwasserstoffsäure erfolgt eine Etherspaltung.[6]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Anisol bildet entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 41 °C. Der Explosionsbereich liegt zwischen 1,2 Vol.‑% (54 g/m³) als untere Explosionsgrenze (UEG) und 6,3 Vol.‑% (283 g/m³) als obere Explosionsgrenze (OEG).[2][20] Die Grenzspaltweite wurde mit 0,82 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[2][20] Die Zündtemperatur beträgt 475 °C.[2][20] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendet wird Anisol als Lösungsmittel, Wärmeübertragungsmittel (zwischen 150 und 260 °C) und Ausgangsstoff für die Synthese organischer Verbindungen wie beispielsweise Arzneimitteln und Riechstoffen.[3]
Anisol ist mit begrenzter Konzentration als Zusatz zu Lebensmitteln[21][22] und Kosmetika[23] zugelassen.
Verwandte Strukturen
[Bearbeiten | Quelltext bearbeiten]Namentlich wie auch strukturell leiten sich vom Anisol durch Einführung eines Kohlenstoffatoms drei weitere Verbindungen ab: Anisalkohol, Anisaldehyd, Anissäure. Die Darstellung von Anisaldehyd erfolgt mittels Vilsmeier-Formylierung.[24]
–CH2OH –CHO –COOH 

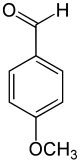

Anisol Anisalkohol Anisaldehyd Anissäure
Zu den Derivaten zählen auch:
- Anisolsulfonsäuren
- Phenetol (Ethoxybenzol)
- Anisidine (Aminoanisole)
- Methylanisole
- Nitroanisole
- Thioanisol (Phenolthioether)

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ANISOLE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i j k l m n o p Eintrag zu Anisol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. Oktober 2023. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Anisol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Oktober 2023.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ Datenblatt Anisole bei Sigma-Aldrich, abgerufen am 25. Juni 2011 (PDF).
- ↑ a b Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus: Phenol Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a19_313.
- ↑ EMBL-EBI, ChEBI, Anisole, https://www.ebi.ac.uk/chebi/searchId.do?chebiId=CHEBI:16579, 2022-09-19.
- ↑ TGSC Information System, Anisole, Use levels for FEMA GRAS flavoring substances on which the FEMA Expert Panel based its judgments that the substances are generally recognized as safe (GRAS), http://www.thegoodscentscompany.com/data/rw1031451.html,, 2019-11-05.
- ↑ El-Saved A.M., The Pherobase, The Pherobase: Database of Pheromones and Semiochemicals, Methoxybenzene, http://www.pherobase.net/database/floral-compounds/floral-taxa-compounds-detail-anisole.php, 2022-09-18.
- ↑ Sachiko Koyama and Thomas Heinbockel, The Effects of Essential Oils and Terpenes in Relation to Their Routes of Intake and Application, Int. J. Mol. Sci., 21, 2020, 1558; doi:10.3390/ijms21051558.
- ↑ Joshi, S.S.; Aminabhavi, T.M.; Shukla, S.S.: Densities and Shear Viscosities of Anisole with Nitrobenzene, Chlorobenzene Carbon Tetrachloride, 1,2-Dichloroethane and Cyclohexane from 25 to 40 °C in J. Chem. Eng. Data 35 (1990) 247–253.
- ↑ Collerson, R.R.; Counsell, J.F.; Handley, R.; Martin, J.F.; Sprake, C.H.S.: Thermodynamic Properties of Organic Oxygen Compounds. Part XV. Purification and Vapour Pressures of Some Ketones and Ethers in J. Chem. Soc. 1965, 3697-3700, doi:10.1039/jr9650003697.
- ↑ Olson, W.T.; Hipsher, H.F.; Buess, C.M.; Goodman, I.A.; Hart, I.; Lamneck, J.H.; Gibbons, L.C.: The Synthesis and Purification of Ethers in J. Am. Chem. Soc. 69 (1947) 2451–2454.
- ↑ a b c Lebedeva, N.D.; Katin, Yu.A.: Heats of combustion of certain monosubstituted benzenes in Russ. J. Phys. Chem. (Engl. Transl.) 46 (1972) 1088.
- ↑ a b Fenwick, J.O.; Harrop, D.; Head, A.J.: Thermodynamic properties of organic oxygen compounds. 41. Enthalpies of formation of eight ethers in J. Chem. Thermodyn. 7 (1975) 943–954, doi:10.1016/0021-9614(75)90158-5.
- ↑ a b Hales, J.L.: Thermodynamic properties of organic oxygen compounds. Part 18. Vapor heat capacities and heats of vaporization of ethyl ketone, ethyl propyl ketone, methyl isopropyl ketone, and methyl phenyl ether in Trans. Faraday Soc. 63 (1967) 1876–1879.
- ↑ a b c Wilson, L.C.; Wilson, H.L.; Wilding, W.V.; Wilson, G.M.: Critical Point Measurements for Fourteen Compounds by a Static Method and a Flow Method J. Chem. Eng. Data 41 (1996) 1252–1254, doi:10.1021/je960052x.
- ↑ Domalski, Eugene S.; Hearing, Elizabeth D.: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III in J. Phys. Chem. Ref. Data 25 (1996) 1, doi:10.1063/1.555985.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Code of Federal Regulations, Title 21, Chapter I, Subchapter B, PART 172 - Food Additives Permitted for Direct Addition to Food for Human Consumption, § 172.515 Synthetic flavoring substances and adjuvants, https://www.ecfr.gov/current/title-21/chapter-I/subchapter-B/part-172, 2022-09-19.
- ↑ Api AM, Belsito D, Botelho D., Bruze M., Burton G.A. Jr, Buschmann J., Cancellieri M.A., Dagli M.L., Date M., Dekant W., Deodhar C., Fryer A.D., Jones L., Joshi K., Kumar M., Lapczynski A., Lavelle M., Lee I., Liebler D.C., Moustakas H., Na M., Penning T.M., Ritacco G., Romine J., Sadekar N., Schultz T.W., Selechnik D., Siddiqi F., Sipes I.G., Sullivan G., Thakkar Y., Tokura Y.. RIFM fragrance ingredient safety assessment, anisole, CAS Registry Number 100-66-3. Food Chem Toxicol. 2022 Jan 15;159 Suppl 1:112680. doi:10.1016/j.fct.2021.112680. Epub 2021 Nov 18. PMID 34800549.
- ↑ European Commission, Ingredient: Anisole, Cosmetics - CosIng, Function: Perfuming, https://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.details_v2&id=39069, 2022-09-19.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 345.









