Naproxen
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Naproxen | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
COX-Hemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 230,26 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Naproxen ist ein Arzneistoff, der schmerzlindernd, fiebersenkend und entzündungshemmend wirkt. Naproxen ist chiral, es wird ausschließlich das (S)-Enantiomer als Arzneistoff verwendet. Chemisch gesehen handelt es sich um ein Arylpropionat.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Naproxen wurde 1968 von der mexikanischen Firma Syntex patentiert[5] und 1973 vorgestellt; Naproxen-Natrium durch Hoffmann-La Roche 1980. Im März 2002 wurde es in Deutschland für Einzeldosen unter 250 mg aus der Rezeptpflicht entlassen.[6]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Zur chemischen Synthese von Naproxen werden mehrere Verfahren beschrieben, darunter auch die Racematspaltung von (RS)-2-(6-Methoxy-2-naphthyl)propionsäure sowie eine asymmetrische Synthese.[7]

Naproxen kann auch durch eine enantioselektive Synthese aus 2-(6-Methoxy-2-naphthyl)acrylsäure hergestellt werden. Danach wird diese an, mit bidentaten Diphosphinliganden und Acetaten komplexierten, Ruthenium-Katalysatoren in Methanol als Lösungsmittel zum (S)-Naproxen hydriert (asymmetrische Hydrierung). Bei Wasserstoffdrücken um 135 bar werden exzellente Ausbeuten von 92 % und ein Enantiomerenüberschuss von 97 % erzielt.[8]
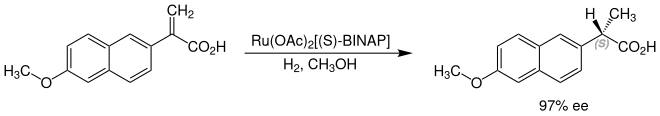
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]Naproxen wird als Arzneistoff ausschließlich als (S)-Enantiomer eingesetzt. Nur dieses ist als nichtsteroidales Antiphlogistikum wirksam.[9]
Wirkung und Wirkungsweise
[Bearbeiten | Quelltext bearbeiten]Naproxen hemmt die Bildung von Prostaglandinen nicht nur durch Inhibition der Cyclooxygenase, sondern auch der hormonsensitiven Lipase.[10] Prostaglandine sind Botenstoffe, welche die Nervenenden reizen, worauf diese dann Schmerzsignale zum Gehirn aussenden. Da dieser Vorgang gehemmt ist, kommt das Schmerzsignal nicht mehr im Gehirn an, und so entsteht die schmerzstillende Wirkung.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Naproxen wird Frauen gegen Menstruationsbeschwerden oder nach Einsetzen einer Spirale verabreicht. Weitere Anwendungsgebiete sind Rheuma und Schwellungen und Entzündungen jeglicher Art (z. B. nach Operationen), aber auch als Schmerzmittel für kleinere Operationen wie beispielsweise Zahnextraktionen. In den Vereinigten Staaten ist Naproxen als allgemeines Schmerzmittel üblich.
Dosierung
[Bearbeiten | Quelltext bearbeiten]Die maximale gesamte Tagesdosis für Erwachsene beträgt 1250 mg Naproxen, wobei die Aufteilung auf zwei bis drei Einzeldosen mit je 200–400 mg üblich ist. Für Kinder über 11 Jahren beträgt die Tageshöchstdosis 15 mg pro Kilogramm Körpergewicht.[11]
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Naproxen wird hauptsächlich im Dünndarm resorbiert, aber auch teilweise im Magen. Die Bioverfügbarkeit beträgt 80–100 %. Nach 2–4 h werden maximale Plasmaspiegel gemessen. Naproxen zeichnet sich durch eine für nichtsteroidale Antirheumatika (NSAR) sehr lange Plasmahalbwertszeit aus (10–18 h). Der Wirkstoff wird hepatisch metabolisiert, wobei es zu Glucuronidierung und Demethylierung kommt. Die Ausscheidung der Metaboliten erfolgt über die Niere.[12]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Nebenwirkungen können auftreten. Nachfolgend die wichtigsten:
- Leber- und Nierenstörungen
- Magen/Darm-Geschwüre
- Übelkeit, Erbrechen
- Hautreizungen (allgemein allergische Reaktionen, wie beispielsweise Urtikaria)
- Schwellungen im Gesicht
- Asthma
- Durchfall
- Blutungen der Magenschleimhaut (können tödlich sein)
- Zentralnervöse Störungen Benommenheit, Müdigkeit, Kopfschmerzen, Sehstörungen (Blitze vor dem Auge), Schwindel
- anaphylaktischer Schock infolge allergischer Reaktion
- Erhöhtes Risiko für Schlaganfall[13]
Naproxen weist im Vergleich zu anderen NSAR (nichtsteroidales Antiphlogistikum) das geringste Risiko für Herzinfarkte und Schlaganfälle auf.[14] Kinder und Jugendliche unter 12 Jahren dürfen kein Naproxen einnehmen. Ältere Personen sollen geringe Dosierungen einhalten. Außerdem soll ausreichend Wasser dazu getrunken werden.
Schwangerschaft und Stillzeit
[Bearbeiten | Quelltext bearbeiten]Nach aktuellem Wissensstand erhöhen Naproxen und andere NSAR in den ersten zwei Dritteln der Schwangerschaft nicht das Fehlbildungsrisiko. Aufgrund der schlechten Datenlage wird jedoch von der Einnahme von Naproxen abgeraten. Es sollte stattdessen das besser untersuchte NSAR Ibuprofen bevorzugt werden. Ab der 28. Schwangerschaftswoche dürfen Naproxen, Ibuprofen und sämtliche NSAR nicht mehr eingenommen werden, da es durch den vorzeitigen Verschluss des Ductus arteriosus Botalli zu Schädigungen des Fetus kommen kann. In dieser Zeit darf nur das Schmerzmittel Paracetamol angewendet werden.
Während der Stillzeit sollte Naproxen aufgrund seiner langen Halbwertszeit nicht angewendet werden, es sei denn, der behandelnde Arzt hält dies für dringend erforderlich. Ibuprofen und Paracetamol sind zu bevorzugen.[15]
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]- NSAR: Bei Medikamenten mit ähnlicher Wirkung wird das Risiko der oben angeführten Nebenwirkungen deutlich erhöht, weshalb Naproxen nicht mit anderen NSAR, wie z. B. Ibuprofen, kombiniert werden darf.
- Alkohol: Bei der Kombination mit Naproxen können die von Alkohol verursachten Nebenwirkungen auf das ZNS oder den Verdauungstrakt auf unvorhersehbare Weise verstärkt werden.
- Antikoagulanzien und Thrombozytenaggregationshemmer: Bei gleichzeitiger Einnahme gerinnungshemmender Medikamente (Marcumar, Clopidogrel) besteht eine erhöhte Blutungsgefahr.
- Blutdrucksenkende Medikamente: Die Wirkung von Diuretika und Antihypertensiva (z. B. ACE-Hemmer, Betablocker) kann durch Naproxen abgeschwächt werden. Außerdem ist in Kombination eine Einschränkung der Nierenfunktion möglich, weshalb die gleichzeitige Einnahme besonders bei älteren Patienten kritisch hinterfragt werden sollte.
- Glucocorticoide: Cortison und andere Glucocorticoide erhöhen das Risiko von gastrointestinalen Blutungen stark, wenn sie mit Naproxen kombiniert werden.
- Methotrexat: Naproxen hemmt die Ausscheidung des Rheuma-Medikaments Methotrexat über die Niere und erhöht dadurch dessen Plasmakonzentration und Toxizität.
- SSRI: Die Kombination von Naproxen mit Antidepressiva aus der Gruppe der selektiven Serotonin-Reuptake-Inhibitoren kann das Risiko von gastrointestinalen Blutungen erhöhen, da das für die Funktion von Thrombozyten wichtige Serotonin nicht in diese aufgenommen werden kann.[16]
Naproxen kann die Wirkung weiterer Medikamente verstärken oder abschwächen.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate: Alacetan (D), Aleve (D, A, CH, USA), Analgesin Forte (Ungarn), Apranax (CH), Dolormin für Frauen (D), Dolormin GS (D), Dysmenalgit (D), Miranax (A), Mobilat Schmerztabletten (D), Naprobene (A), Naproxen (D), Proxen (D, A, CH), zahlreiche Generika (D, A, CH)
Kombipräparate: Vimovo (D, A, CH): Das Präparat enthält neben Naproxen den Protonenpumpenhemmer Esomeprazol.[17]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu NAPROXEN in der CosIng-Datenbank der EU-Kommission, abgerufen am 27. Juni 2020.
- ↑ a b c d e Datenblatt Naproxene bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1109.
- ↑ a b K. Tsinman, A. Avdeef, O. Tsinman, D. Voloboy: Powder Dissolution Method for Estimating Rotating Disk Intrinsic Dissolution Rates of Low Solubility Drugs in Pharm Res 26 (2009) 2093-2100, doi:10.1007/s11095-009-9921-3.
- ↑ a b c Römpp Lexikon Chemie, Georg Thieme Verlag, Stuttgart - New York, 10. Auflage, 1998, S. 2813 f.
- ↑ Govi-Verlag Pharmazeutischer Verlag: Pharmazeutische Zeitung online: Naproxen-Präparate im Test. In: pharmazeutische-zeitung.de. 20. Dezember 2004, abgerufen am 6. Juni 2015.
- ↑ C. Giordano M. Villa, S. Panossian Panossian: Naproxen: Industrial Asymmetric Synthesis. In: A. N. Collins, G. N. Sheldrake, J. Crosby (Hrsg.): Chirality in Industry Wiley, 1992, ISBN 0-471-93595-6, S. 303–312.
- ↑ Tetsuo Ohta, Hidemasa Takaya, Masato Kitamura, Katsunori Nagai, and Ryoji Noyori: Asymmetric hydrogenation of unsaturated carboxylic acids catalyzed by BINAP-ruthenium(II) complexes. In: J. Org. Chem. 52. Jahrgang, Nr. 14, 1987, S. 3174–3176, doi:10.1021/jo00390a043.
- ↑ Carsten Schmuck, Bernd Engels, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner, Pearson Studium, ISBN 978-3-8273-7286-4, S. 413.
- ↑ M. O. Taha, L. A. Dahabiyeh, Y. Bustanji, H. Zalloum, S. Saleh: Combining ligand-based pharmacophore modeling, quantitative structure-activity relationship analysis and in silico screening for the discovery of new potent hormone sensitive lipase inhibitors. In: Journal of medicinal chemistry. Band 51, Nummer 20, Oktober 2008, S. 6478–6494, doi:10.1021/jm800718k, PMID 18808096.
- ↑ Gelbe Liste Online: Naproxen - Anwendung, Wirkung, Nebenwirkungen | Gelbe Liste. Abgerufen am 13. Oktober 2021.
- ↑ Gelbe Liste Online: Naproxen - Anwendung, Wirkung, Nebenwirkungen | Gelbe Liste. Abgerufen am 13. Oktober 2021.
- ↑ M. D. Haag, M. J. Bos, A. Hofman, P. J. Koudstaal, M. M. Breteler, B. H. Stricker: Cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs and risk of stroke. In: Archives of internal medicine. Band 168, Nummer 11, Juni 2008, S. 1219–1224, doi:10.1001/archinte.168.11.1219, PMID 18541831.
- ↑ NAPROXEN NEUER STANDARD - arznei telegramm. In: arznei-telegramm.de. 12. Januar 2007, abgerufen am 13. November 2016.
- ↑ Embryotox - Arzneimittelsicherheit in Schwangerschaft und Stillzeit: Naproxen. Abgerufen am 13. Oktober 2021.
- ↑ Gelbe Liste Online: Wirkstoff Naproxen - Präparate | Gelbe Liste. Abgerufen am 13. Oktober 2021.
- ↑ patienteninfo-service.de: Vimovo 500 mg / 20 mg Tabletten mit veränderter Wirkstofffreisetzung (abgerufen am 7. März 2013).