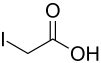
Iodessigsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Iodessigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3IO2 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber, hygroskopischer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 185,96 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,6 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
208 °C[2] | ||||||||||||||||||
| pKS-Wert |
3,18[3] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (600 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Iodessigsäure (auch: Monoiodessigsäure) ist ein Derivat der Essigsäure, bei welcher ein Wasserstoffatom der Methylgruppe durch ein Iodatom ersetzt ist. Ihre Salze werden als (Mono-)Iodacetate bezeichnet.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung erfolgt durch Umsetzung von Chloressigsäure mit Kaliumiodid[5] (nukleophile Substitution):
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Iodessigsäure bildet farblose Kristalle mit stechendem Geruch, die bei 82–83 °C schmelzen und sich sehr leicht in Wasser, Ethanol, Diethylether und anderen organischen Lösungsmitteln lösen. Die wässrige Lösung reagiert stark sauer, deutlich stärker sauer als Essigsäure. Der Grund dafür ist die Stabilisierung des Anions durch das recht elektronegative Iodatom: Es wirkt elektronenziehend und verteilt (delokalisiert) die negative Ladung des Anions über das gesamte Molekül. Das Anion bildet sich daher leichter als das entsprechende Anion der Essigsäure. In wässriger Lösung dissoziiert die Iodessigsäure unter Bildung von Oxonium- und Iodacetat-Ionen.
Iodessigsäure ist, wie viele andere Alkyliodide auch, bei Lichteinwirkung instabil und zersetzt sich dabei recht leicht. Iodessigsäure ist daher in braunen Flaschen bei Temperaturen unterhalb von 15 °C zu lagern.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Iodessigsäure ist Ausgangsstoff für verschiedene Synthesen, beispielsweise für Pflanzenschutzmittel oder Arzneistoffe. So kann das Mukolytikum (ein Sekretlöser bei Erkältungskrankheiten) Carbocystein aus L-Cystein und Iodessigsäure hergestellt werden.
Direkte Anwendung findet Iodessigsäure in der Biochemie. Iodessigsäure alkyliert irreversibel die SH-Gruppe von Proteinen, beispielsweise die Glycerinaldehydphosphat-Dehydrogenase. Sie kann dazu verwendet werden, Enzyme mit –SH an der aktiven Stelle irreversibel zu deaktivieren. Diese Eigenschaft der irreversiblen Enzymblockade bedingt auch die Giftigkeit der Iodessigsäure.
Prinzipiell ist Iodessigsäure, wie auch Bromessigsäure, als Konservierungsmittel geeignet. Wegen der relativ hohen Toxizität und Instabilität wird sie allerdings kaum eingesetzt.
Gefahren
[Bearbeiten | Quelltext bearbeiten]Iodessigsäure und ihre Lösungen wirken stark ätzend und sind giftig.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Iodessigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ Datenblatt Iodessigsäure bei Sigma-Aldrich, abgerufen am 4. Januar 2016 (PDF).
- ↑ Zvi Rappoport (Hrsg.): CRC Handbook of Tables for Organic Compound Identification. 3rd Edition, CRC Press/Taylor and Francis, Boca Raton, FL, 1967, ISBN 0-8493-0303-6, Acid Dissociation Constants of Organic Acids in Aqueous Solution, S. 430.
- ↑ Eintrag zu Iodoacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag zu Iodessigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Mai 2014.


