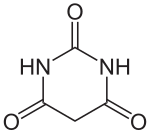
Barbitursäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Barbitursäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver mit schwachem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 128,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert |
4,01 (25 °C)[2] | ||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (11,45 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−634,7 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Barbitursäure ist eine heterocyclische chemische Verbindung, die als Ausgangssubstanz zur Herstellung der Barbiturate und in der Analytik Verwendung findet. Die Substanz zählt zu den Derivaten des Harnstoffs, zu den Lactamen, ist ein cyclisches Ureid und gleichzeitig ein hydrierter Abkömmling des Pyrimidins.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Konstitution der Barbitursäure wurde erstmals 1864 von Adolf von Baeyer bei seinen Studien über Harnsäure erkannt.[5] Er soll seine Entdeckung nach seiner Geliebten Barbara benannt haben.[6] Nach anderen Quellen bekam die Barbitursäure zu Ehren der Alchemistin Barbara von Cilli (1390–1451) ihren Namen.[7]
Baeyer fand heraus, dass die Verbindung zu Harnstoff und Malonsäure hydrolysiert werden kann. Die Synthese aus diesen Abbauprodukten wurde 1879 von dem französischen Chemiker Grimaux realisiert, der diese mit Phosphoroxychlorid als wasserentziehendem Mittel reagieren ließ.[8]
Nach der Synthese der Diethylbarbitursäure im Jahr 1902 und deren Anwendung unter dem Handelsnamen Veronal verbreitete sich die Verwendung der Barbitursäure, deren Eigenschaften man durch chemische Abwandlung zu verbessern versuchte.[9][10]
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Barbitursäure kann aus Harnstoff und einem Malonsäureester, z. B. Malonsäurediethylester, in wasserfreiem Ethanol mit darin gelöstem Natriumethanolat hergestellt werden:[11]
Eigenschaften
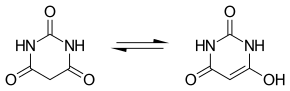
[Bearbeiten | Quelltext bearbeiten]Für die Barbitursäure kann ein Tautomeriegleichgewicht mit einer Keto- und einer Enolform formuliert werden. In der Gasphase[12][13][14] und in Lösung[15][16] liegt das Gleichgewicht auf der Seite der Ketoform, die unter diesen Bedingungen die stabile Form darstellt.
In fester Phase existieren vier polymorphe Anhydratformen[17] sowie zwei polymorphe Dihydratformen.[18] Die Kristallgitter der Anhydratformen I, II und III enthalten das Ketotautomer.[17] Das Polymorph IV besteht aus Molekülen des Enoltautomers, welches wegen der stabilisierenden Wirkung von Wasserstoffbrücken das thermodynamisch stabile Polymorph darstellt.[17] Es zeigt bei 172 °C eine endotherme Festphasenumwandlung zum Polymorph II. Beide Polymorphe stehen enantiotrop zueinander.[17] Das Polymorph II wandelt sich bei 240 °C enantiotrop in das Hochtemperaturpolymorph III um, welches dann bei 253 °C schmilzt.[19] Das Dihydrat bildet unterhalb von −56 °C eine monokline Tieftemperaturform.[18] Oberhalb dieser Temperatur existiert eine orthorhombische Hochtemperaturform.[18][20] Oberhalb von 30 °C dehydratisiert diese Form zur Anhydratform II.[19]
Wie der Name sagt, reagiert die Verbindung sauer. Ihr pKs-Wert beträgt 4,01. Daher wurde früher diskutiert, ob die Formel der Barbitursäure nicht als 2,4,6-Trihydroxypyrimidin geschrieben werden sollte. Dies ist eine tautomere Form des cyclischen Harnstoff-Derivates.
Später wurde erkannt, dass die Imid-Form selbst als Säure fungieren kann: Ihr Anion (Barbiturat) ist durch Delokalisierung der negativen Ladung stabilisiert.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Barbitursäure ist selbst nicht sedativ-hypnotisch wirksam. Erst Derivate mit geeigneten Substituenten haben eine hypnotische Wirkung (siehe Barbiturate). Als erstes derartiges Barbiturat wurde 1903 Diethylbarbitursäure (Barbital) von Emil Fischer und Joseph von Mering beschrieben.[21][22]
In der Trink- und Abwasseranalytik wird Barbitursäure als Reagenz zur kolorimetrischen Cyanidanalyse (CN−-Ion) verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Barbitursäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2016. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-43.
- ↑ Eintrag zu Barbituric acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Adolf Baeyer: Untersuchungen über die Harnsäuregruppe. In: Justus Liebigs Annalen der Chemie. Band 131, Nr. 3, 1864, S. 291–302. doi:10.1002/jlac.18641310306.
- ↑ Werner E. Gerabek: Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 138.
- ↑ Geschichte eines Schlafmittels. In: Pharmazeutische Zeitung.
- ↑ Grimaux: Bulletin de la Societe Chimique de France. Folge 2, Band 31, 1879, S. 146; Annales de Chimie. Folge 5, Band 17, S. 277. Zitiert nach Beilsteins Handbuch der Organischen Chemie. Band 24, S. 467.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- ↑ L. Bogendörfer: Über lösliche Schlafmittel der Barbitursäurereihe. In: Schweizer medizinische Wochenschrift. Band 54, 1924, S. 437 ff.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 468, ISBN 3-342-00280-8.
- ↑ F. Zuccarello, G. Buemi, C. Gandolfo, A. Contino: Barbituric and thiobarbituric acids: a conformational and spectroscopic study. In: Spectrochim. Acta. A 59, 2003, S. 139–151, doi:10.1016/S1386-1425(02)00146-4.
- ↑ V. B. Delchev: DFT ab initio study of the keto-enol tautomerism of barbituric acid. In: J. Struct. Chem. 45, 2004, S. 570–578, doi:10.1007/s10947-005-0031-8.
- ↑ S. Ralhan, N. K. Ray: Density functional study of barbituric acid and its tautomers. In: J. Mol. Struct. THEOCHEM. 634, 2003, S. 83–88, doi:10.1016/S0166-1280(03)00260-4.
- ↑ M. Eigen, G. Ilgenfritz, W. Kruse: Eine kinetische Methode zur Untersuchung schneller prototroper Tautomerisierungsreaktionen. In: Chem. Ber. 98, 1965, S. 1623–1638, doi:10.1002/cber.19650980539.
- ↑ K. Senthilkumar, P. Kolandaivel: Quantum chemical studies on tautomerism of barbituric acid in gas phase and in solution. In: J. Comput.-Aided Mol. Des. 16, 2002, S. 263–272, doi:10.1023/A:1020273219651.
- ↑ a b c d M. U. Schmidt, J. Brüning, J. Glinnemann, M. W. Hützler, P. Mörschel, S. N. Ivashevskaya, J. van de Streek, D. Braga, L. Maini, M. R. Chierotti, R. Gobetto: Die thermodynamisch stabile Form von fester Barbitursäure: das Enol-Tautomer. In: Angew. Chem. 123, 2011, S. 8070–8072, doi:10.1002/ange.201101040.
- ↑ a b c G. S. Nichol, W. Clegg: A variable-temperature study of a phase transition in barbituric acid dihydrate. In: Acta Cryst. B 61, 2005, S. 464–472, doi:10.1107/S0108768105017258.
- ↑ a b N. Zencirci, E. Gstrein, C. Langes, U. J. Griesser: Temperature- and moisture-depent phase changes in crystal forms of barbituric acid. In: Thermochim. Acta. 485, 2009, S. 33–42, doi:10.1016/j.tca.2008.12.001.
- ↑ G. A. Jeffrey, S. Ghose, J. O. Warwicker: The Crystal Structure of Barbituric Acid Dihydrate. In: Acta Cryst. 14, 1961, S. 881–887, doi:10.1107/S0365110X61002540.
- ↑ E. Fischer, J. von Mering: Über eine neue Klasse von Schlafmitteln. In: Therapie der Gegenwart. Band 44 1903, S. 97–101.
- ↑ Vgl. auch R. Bumm: Intravenöse Narkosen mit Barbitursäurederivaten. In: Klinische Wochenschrift. Band 6, 1927, S. 725 ff.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. R. Partington: A History of Chemistry. Band 4, 1964, OCLC 270846068, S. 777.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 21. Auflage. Hirzel, Stuttgart 1988, ISBN 3-7776-0438-0, S. 784.