Ammoniumeisen(III)-sulfat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 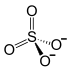
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumeisen(III)-sulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farbloser, durch Spuren von Mangan oft blassvioletter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,71 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser (1240 g·l−1 bei 25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ammoniumeisen(III)-sulfat, ist ein Salz bestehend aus Eisen-, Ammonium- und Sulfationen. Es besitzt die Formel NH4Fe(SO4)2.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Das zur Gruppe der Alaune gehörende Ammoniumeisen(III)-sulfat-Dodecahydrat bildet wasserlösliche, blassviolette kubische Kristalle mit der Dichte von 1,71 g/cm3 und einer molaren Masse von 482,19 g/mol. Der Schmelzpunkt liegt zwischen 39 und 41 °C. Es geht beim Erwärmen ab 230 °C in die wasserfreie Form NH4Fe(SO4)2 mit einer molaren Masse von 266,00 g/mol über. In Lösung wird mit Kaliumhexacyanoferrat(II), dem gelben Blutlaugensalz, das Berliner Blau gebildet. In verdünnter wässriger Lösung ist Ammoniumeisen(III)-sulfat nicht stabil und auch in konzentrierten Lösungen zersetzt es sich bei Erwärmen.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendung findet das Ammoniumeisen(III)-sulfat-Dodecahydrat als Indikator bei Titration nach Volhard. Des Weiteren kommt es als Beize in der Textilindustrie und in der Medizin als Adstringens zum Einsatz.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Ammoniumeisen(III)-sulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2014.
- ↑ a b Datenblatt Ammoniumeisen(III)-sulfat bei Alfa Aesar, abgerufen am 1. Februar 2012 (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu Ammoniumeisen(III)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ J. H. Long: ON THE SPEED OF REDUCTION OF FERRIC ALUM BY SUGAR. In: Journal of the American Chemical Society. Band 19, Nr. 9, September 1897, S. 683–698, doi:10.1021/ja02083a001.

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
