2-Phenylphenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Phenylphenol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C12H10O | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis rosafarbener Feststoff mit phenolartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 170,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,26 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
286 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
10,01 (25 °C)[3] | ||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (0,7 g·l−1 bei 20 °C)[2], löslich in Ethanol, Aceton und Benzol, sehr gut löslich in Diethylether und Pyridin[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
5 mg·m−3 (gemessen als einatembarer Aerosolanteil)[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2-Phenylphenol (auch Orthophenylphenol) ist eine organische Verbindung aus der Stoffgruppe der Hydroxybiphenyle. Es besteht aus einem Phenol, das in ortho-Position einen Phenylrest trägt.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]2-Phenylphenol wurde früher aus überdestillierten Schwerölen des Steinkohlenteers gewonnen.
Die industrielle Standardsynthese geht aus von Cyclohexanon, das in einer Aldol-Addition zum Dimer reagiert. Beim Erhitzen in Gegenwart von Carbonsäuresalzen von Übergangsmetallen, wie z. B. Vanadinstearat, spaltet das Additionsprodukt Wasser ab und bildet ein Isomerengemisch zweier Aldolkondensationsprodukte (95 % Ausbeute).
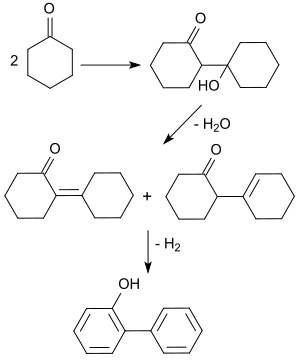
Deren Dehydrierung an einem Platin-Kontakt bei hohen Temperaturen (270 °C) erzeugt in 85%iger Ausbeute 2-Phenylphenol.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Phenylphenol ist ein farbloser, kristalliner Feststoff mit nur schwachem Geruch. Es ist in Wasser nur sehr schwer löslich, aber gut löslich in Alkoholen, z. B. Methanol und Ethanol, sowie in Acetonitril und Pyridin.[7] Der Flammpunkt liegt bei 138 °C, die Zündtemperatur bei >520 °C.[2]
In verdünnter Natronlauge ist OPP unter Bildung von Natrium-2-phenylphenolat sehr gut löslich. Wegen seiner extremen Wasserlöslichkeit (1,200 g/l) wird in wässrigen Zubereitungen ausschließlich das Natriumsalz verwendet.
Verwendung
[Bearbeiten | Quelltext bearbeiten]2-Phenylphenol war in der EU als Lebensmittelzusatzstoff E231 (bzw. das Natrium-Salz als E232) zur Konservierung von Zitrusfrüchten mit einem Grenzwert von 12 mg/kg zugelassen.[8] Der Grenzwert, welcher bei anderem Obst und Gemüse gilt, wird dabei um das 50-fache überschritten.[9] Gemäß der Richtlinie 2003/114/EG[10] gehört 2-Phenylphenol (Orthophenylphenol und Natriumorthophenylphenol) seit November 2014 nicht mehr zu den Lebensmittelzusatzstoffen, sondern wird den gesetzlichen Regelungen der Pflanzenschutzmittel unterworfen.
o-Phenylphenol ist wirksam gegen Bakterien, Hefen, Pilze und umhüllte Viren und wird (meist in Kombination mit anderen Desinfektionsmitteln) zur Oberflächendesinfektion insbesondere in Krankenhäusern und Pflegeheimen eingesetzt.[11]
Der Wissenschaftliche Ausschuss „Verbrauchersicherheit“ (SCCS) der Europäischen Kommission empfiehlt eine maximale Konzentration von 0,2 % OPP in (abwaschbaren) Kosmetika.[7]
Auch zur Konservierung wässriger Zubereitungen, wie z. B. bei Klebstoffe, Betonadditiven und Pigmentsuspensionen, wird Biphenyl-2-ol eingesetzt.
Als funktionelles Biphenyl ist Biphenyl-2-ol ein Ausgangsstoff für das Flammschutzmittel DOPO. Zusätzlich dient es als Färbebeschleuniger bei der Chemiefaserfärbung.[2]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- International Chemical Safety Card (ICSC) für o-Phenylphenol bei der International Labour Organization (ILO)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu O-PHENYLPHENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d e f g h i j k l m n o Eintrag zu 2-Phenylphenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-50.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics. 97. Auflage. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–306 (englisch).
- ↑ Eintrag zu Biphenyl-2-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Patent US3980716: Production of ortho-phenylphenol from cyclohexanone. Angemeldet am 2. April 1973, veröffentlicht am 14. September 1976, Anmelder: Imperial Chemical Industries, Ltd., Erfinder: C.S. Elliott.
- ↑ a b ADDENDUM to the scientific opinion on o-Phenylphenol, Sodium o-phenylphenate and Potassium o-phenylphenate (SCCS/1555/15). In: SCCS/1597/18. Scientific Committee on Consumer Safety SCCS, 21. Februar 2018, abgerufen am 28. Mai 2018.
- ↑ ZZulV: Anlage 5 (zu § 5 Abs. 1 und § 7) Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind
- ↑ EuGH: Der Gerichtshof bestätigt, dass die Kennzeichnung von Zitrusfrüchten mit der Angabe von Konservierungsmitteln und anderen bei der Behandlung nach der Ernte verwendeten chemischen Stoffen verbindlich ist In: curia.europa.eu, 3. März 2016, abgerufen am 22. Juni 2018.
- ↑ Richtlinie 2003/114/EG zur Streichung von E 231 und E 232 als Lebensmittelzusatzstoffe
- ↑ Guideline for Disinfection and Sterilization in Healthcare Facilities (2008). CDC Centers for Disease Control and Prevention, 15. Februar 2017, abgerufen am 28. Mai 2018.


