Chlorbenzoesäuren
Die Chlorbenzoesäuren bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Chlorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxygruppe (–COOH) und Chlor (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5ClO2.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Chlorbenzoesäuren | ||||||
| Name | 2-Chlorbenzoesäure | 3-Chlorbenzoesäure | 4-Chlorbenzoesäure | |||
| Andere Namen | o-Chlorbenzoesäure | m-Chlorbenzoesäure | p-Chlorbenzoesäure | |||
| Strukturformel | 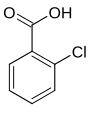
|

|
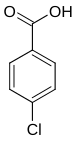
| |||
| CAS-Nummer | 118-91-2 | 535-80-8 | 74-11-3 | |||
| PubChem | 8374 | 447 | 6318 | |||
| Summenformel | C7H5ClO2 | |||||
| Molare Masse | 156,57 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Kurzbeschreibung | farbloses Pulver | beiges kristallines Pulver | weißes kristallines Pulver | |||
| Schmelzpunkt | 139–142 °C[1] | 153–156 °C[2] | 237–240 °C[3] | |||
| Siedepunkt | 285 °C[1] | 274–276 °C[2] | 274–276 °C[3] | |||
| pKs-Wert[4] | 2,92 | 3,82 | 3,98 | |||
| Löslichkeit | 2,1 g/l (25 °C)[1] | 0,45 g/l (20 °C)[2] | 0,08 g/l (20 °C)[3] | |||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | 315‐319 | 315‐319 | 302‐315‐319‐335 | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 302+352‐305+351+338 | 264‐280‐302+352‐305+351+338‐332+313‐337+313 | 261‐305+351+338 | ||||
Darstellung
[Bearbeiten | Quelltext bearbeiten]4-Chlorbenzoesäure wird aus 4-Chlortoluol durch Oxidation der Methylgruppe mit Kaliumpermanganat in alkalischer Lösung dargestellt (in Gegenwart eines Phasentransferkatalysators).[5] Die Darstellung von 2-Chlorbenzoesäure ist aus der Umsetzung einer Diazoniumsalzlösung (welche zuvor aus 2-Aminobenzoesäure und Salpetriger Säure [ihrerseits in situ hergestellt aus Natriumnitrit und einer starken Säure, z. B. Salzsäure] frisch bei <5 °C hergestellt wurde) mit Salzsäure und Kupfer(I)-chlorid als Katalysator möglich (Sandmeyer-Reaktion).
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Chlorbenzoesäuren sind farblose bis beige kristalline Feststoffe. Die Schmelzpunkte unterscheiden sich deutlich. Die 4-Chlorbenzoesäure, die die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Chlorbenzoesäuren weisen aufgrund des −I-Effekts des Chlorsubstituenten eine höhere Acidität im Vergleich zur Benzoesäure auf. Die pKs-Werte sind daher entsprechend niedriger (Benzoesäure: 4,20[4]).
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu 2-Chlorbenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Dezember 2012. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu 3-Chlorbenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu 4-Chlorbenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. November 2017. (JavaScript erforderlich)
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 367–368.
