Eisenpentacarbonyl
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Eisenpentacarbonyl | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | [Fe(CO)5] | |||||||||||||||
| Kurzbeschreibung |
ölige gelbe bis rote Flüssigkeit mit muffigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 195,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
105 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,453 (22 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,8 mg·m−3 (berechnet als Eisen)[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eisenpentacarbonyl ist eine Komplexverbindung und neben dem Dieisennonacarbonyl Fe2(CO)9 und dem Trieisendodecacarbonyl Fe3(CO)12 das einfachste der drei bekannten Carbonyle des Eisens.[3] Es liegt bei Standardbedingungen als strohgelbe Flüssigkeit vor.[3]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Technisch wird Eisenpentacarbonyl aus feinverteiltem Eisen und Kohlenmonoxid bei 150 bis 200 °C unter einem Druck von 50 bis 300 bar hergestellt.[6][7] Reines Eisen ohne Oxidschicht reagiert mit CO bereits bei Raumtemperatur und Normaldruck. Die Aufreinigung erfolgt mittels Destillation. Es handelt sich um eine Gleichgewichtsreaktion, deren Lage stark von der Temperatur und dem Druck abhängt. Die Bildung von Eisenpentacarbonyl verläuft mit −226,92 kJ·mol−1 exotherm.[2]
Bei hohen Temperaturen wird die Rückreaktion bzw. Zersetzung relevant, die neben Kohlenmonoxid ein besonders reines Eisenpulver (99,98 bis 99,999 % Eisen), das sogenannte Carbonyleisen, liefert.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]

Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Eisenpentacarbonyl ist eine gelb bis rote Flüssigkeit, die unter Normaldruck bei 105 °C siedet. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,18943, B = 1960,896 und C = −0.228 im Temperaturbereich von 267 bis 378 K.[8]
Zusammenstellung der wichtigsten physikalischen Eigenschaften[2] Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid −766,09 kJ·mol−1[9]
−3911 kJ·kg−1als Flüssigkeit Verbrennungsenthalpie ΔcH0liquid −1606 kJ·mol−1
−8200 kJ·kg−1als Flüssigkeit zu CO2 und Fe2O3 Wärmekapazität cp 235 J·mol−1·K−1 (20 °C)
1,2 J·g−1·K−1 (20 °C)als Flüssigkeit Kritische Temperatur Tc 285–288 °C Kritischer Druck pc 2,90 MPa Viskosität η 76 mPa·s (20 °C) Wärmeleitfähigkeit λ 0,139 W·m−1·K−1 Linearer Ausdehnungskoeffizient α 0,00125 K−1 Schmelzenthalpie ΔFH 13,6 kJ·mol−1
69,4 kJ·kg−1am Schmelzpunkt Verdampfungsenthalpie ΔVH 37,2 kJ·mol−1
190 kJ·kg−1am Normaldrucksiedepunkt Brechungsindex nD22 1,518
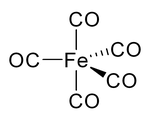
Untersuchungen mittels Röntgendiffraktometrie bei −100 °C zeigten, dass das Molekül eine trigonal bipyrimidale Struktur besitzt.[10][11] Die Verbindung ist vollständig mischbar mit Petrolether, n-Hexan, Benzol, n-Pentanol und anderen höheren Alkoholen, Diethylether, Aceton, Essigsäure und Ethylacetat.[2]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Eisenpentacarbonyl reagiert bei Raumtemperatur nicht mit Luftsauerstoff.[10] Die Verbindung ist gegenüber Wasser und schwachen bzw. verdünnten Säuren stabil. Mit konzentrierten Säuren werden die korrespondierenden Salze unter Freisetzung von Kohlenmonoxid und Wasserstoff gebildet. Aus den Reaktionen mit Halogenen resultieren die entsprechenden Eisenhalogenide.[2] Die Verbindung wirkt gegenüber organischen Verbindungen als Reduktionsmittel. So können Nitroaromaten zu Anilinen oder Ketone zu Alkoholen reduziert werden. Die Hiebersche Basenreaktion führt zu Eisencarbonylsalzen, wie Natriumtetracarbonylferrat, die ebenfalls starke Reduktionsmittel darstellen.[2]
Die Photolyse der reinen Verbindung oder ihrer Lösungen ergibt das Dieisennonacarbonyl.[2] Diese Reaktion erfolgt auch bei Einwirkung von Licht im sichtbaren Spektralbereich, sodass Dieisennonacarbonyl als Verunreinigung bei Einwirkung von Tageslicht gebildet werden kann.[10]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Eisenpentacarbonyl bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −15 °C.[1] Der Explosionsbereich liegt zwischen 3,7 Vol.‑% als unterer Explosionsgrenze (UEG) und 12,5 Vol.‑% als oberer Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 55 °C.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Eisenpentacarbonyl dient als Ausgangsstoff für die Synthese von metallorganischen Eisenverbindungen, die u. a. vielseitige katalytische Eigenschaften haben.[10]
Früher wurde es als Antiklopfmittel im Benzin verwendet, zum Beispiel in Motalin (Superbenzin auf Basis des synthetischen Leuna-Benzins im Deutschland der 1920er- und 1930er-Jahre). Allerdings wurde diese Verwendung aufgegeben, da sich Eisenoxide im Motor und an den Zündkerzen ablagerten. Mit Eisenpentacarbonyl wären 92 ROZ bei einer Zugabekonzentration von ca. 6,5 g/l[12] erreichbar gewesen.
Eisenpentacarbonyl wird zur Herstellung halbtransparenter Eisenoxidpigmente mit sehr hohen chemischer Reinheit verwendet. Dabei erfolgt eine Verbrennung in einem Überschuss an Luftsauerstoff bei Temperaturen zwischen 580 °C und 800 °C. Es resultieren orange bis rote, amorphes Produkte mit kleinen Korngrößen zwischen 10 und 20 nm.[13]
Durch kontrollierte Verbrennung in Gegenwart von Aluminiumpulver in einem Wirbelschichtreaktor bei 450 °C können spezielle Effektpigmente hergestellt werden. Hier erfolgt eine Beschichtung der Aluminiumpartikel mit α–Eisen(III)-oxid, wobei über verschiedene Schichtdicken verschiedene goldene, orange oder rote Farbtöne mit hoher Farbbrillanz erreicht werden können.[13]
Eisenpentacarbonyl diente in der DDR als Roststopper bzw. Rostschutzmittel. Es wurde verwendet, um Rostflecke auf metallischen Oberflächen zu beseitigen bzw. als Grundierungsanstrich auf Stahl. Dies war eine rotbraune, leicht ölige Flüssigkeit mit schwachem Geruch.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Kurven zu Zusammenhängen zwischen Additivkonzentration und erzielbarer ROZ, abgerufen am 23. Dezember 2016.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o Eintrag zu Eisenpentacarbonyl in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d e f g h i j E. Wildermuth, H. Stark, G. Friedrich, F. L. Ebenhöch, B. Kühborth, J. Silver, R. Rituper: Iron Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a14_591.
- ↑ a b c d Eintrag zu Eisencarbonyle. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. November 2017.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-308.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 13463-40-6 bzw. Eisenpentacarbonyl), abgerufen am 2. November 2015.
- ↑ Wiberg, E.; Wiberg, N.; Holleman, A.F.: Anorganische Chemie, 103. Auflage, 2017 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-026932-1, S. 2119, (abgerufen über De Gruyter Online).
- ↑ a b M. Bertau, A. Müller, P. Fröhlich, M. Katzberg: Industrielle Anorganische Chemie. 4. Auflage. John Wiley & Sons, 2013, ISBN 978-3-527-33019-5, S. 260.
- ↑ D. R. Stull: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540, doi:10.1021/ie50448a022
- ↑ M. W. Chase, Jr.: NIST-JANAF Themochemical Tables. In: J. Phys. Chem. Ref. Data, Monograph. 9, 1998, 1-1951.
- ↑ a b c d e-EROS Encyclopedia of Reagents for Organic Synthesis. 1999–2013, John Wiley and Sons, Eintrag für Pentacarbonyliron, abgerufen am 21. November 2017.
- ↑ D. Braga, F. Grepioni, A. G. Orpen: Nickel carbonyl [Ni(CO)4] and iron carbonyl [Fe(CO)5]: molecular structures in the solid state. In: Organometallics. 12, 1993, S. 1481–1483, doi:10.1021/om00028a082.
- ↑ Antiklopfmittel
- ↑ a b G. Pfaff: Inorganic Pigments. Walter de Gruyter, Berlin/Boston 2017, ISBN 978-3-11-048450-2, S. 199 und S. 216.



![{\displaystyle \mathrm {Fe+5\ CO\ \rightleftharpoons \ [Fe(CO)_{5}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3779a7c014440a7d7b8145ccdee156fabddf2bb)


