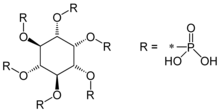
Phytinsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phytinsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H18O24P6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 660,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest (Kaliumsalz)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||

Phytinsäure (Hexaphosphorsäureester des myo-Inosits, IP6) gehört zu den bioaktiven Substanzen. Sie dient in Pflanzen wie Hülsenfrüchten, Getreide und Ölsaaten als Speicher für Phosphat und Kationen (für Kalium-, Magnesium-, Calcium-, Mangan-, Barium- und Eisen(II)-Ionen), die der Keimling zum Wachstum benötigt. Aufgrund ihrer komplexbildenden Eigenschaften kann sie vom Menschen mit der Nahrung aufgenommene Mineralstoffe wie Calcium, Magnesium, Eisen und Zink in Magen und Darm unlöslich binden, so dass diese dem Körper nicht mehr zur Verfügung stehen.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Phytinsäure wird aus Maisquellwasser[3] und Reisschalen gewonnen und kommt in der Natur als Anion, Phytat genannt, vor.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Phytinsäure und ihre Metallsalze werden als Komplexbildner hauptsächlich in der Lebensmittelindustrie[4] und als Düngerzusatz, beispielsweise für Hydrokulturdünger, eingesetzt.
Nuklearmedizin
[Bearbeiten | Quelltext bearbeiten]Das radioaktive 99mTechnetiumphytat wird in der Nuklearmedizin als Tracer bei der statischen Leberszintigrafie verwendet.
Lebensmittel
[Bearbeiten | Quelltext bearbeiten]Außerhalb der EU werden die Salze Calciumphytat und Calcium-Magnesium-Phytat als Klärmittel für Getränke eingesetzt.[5]
Restaurierung
[Bearbeiten | Quelltext bearbeiten]Bei der Restaurierung historischer Dokumente nutzt man Phytat, um das Eisen in Eisengallustinten zu komplexieren und die Oxidation der Zellulose und damit den Zerfall der Dokumente (sog. „Tintenfraß“) zu beenden.[6][7]
Phytinsäure in der Ernährung
[Bearbeiten | Quelltext bearbeiten]Mineralien werden in der Regel im Dünndarm resorbiert. Bestimmte Nahrungsbestandteile allerdings, zu denen auch die Phytinsäure zählt,[8] können mit Mineralien feste Komplexe bilden und dadurch deren Aufnahme in den Körper behindern. Außerdem werden körpereigenes Calcium, Magnesium und Zink in einem Recycling-Prozess über die Verdauungssekrete der Bauchspeicheldrüse wieder in den Dünndarm abgegeben und von dort aus normalerweise rückresorbiert.
Da die durch Phytinsäure gebundenen Mineralstoffe vom Körper nicht aufgenommen werden können, wird sie teils als unerwünschter Inhaltsstoff in Lebensmitteln angesehen. Methoden zur Reduktion von Phytinsäure sind:[9]
- Kochen / Einweichen in warmem Wasser
- Keimen lassen
- Fermentierung
- Bei der Herstellung von Vollkornprodukten spezielle Teigführung
Bei phytinreicher Ernährung empfiehlt die DGE seit 2019 eine erhöhte Zinkzufuhr.[10]
Diskutiert werden neben den antinutritiven Eigenschaften der Phytinsäure auch mögliche positive Eigenschaften als Antioxidans und ein Schutz gegen Krebs oder Nierensteine.[11] Zu einer gesunden Ernährung gehören daher trotz bzw. wegen der enthaltenen Phytinsäure Vollkornprodukte, Hülsenfrüchte, Gemüse, Samen und Nüsse.[12]
Phytat und Gülle
[Bearbeiten | Quelltext bearbeiten]Wiederkäuer sind die einzigen Säugetiere, die Phytinsäure abbauen und das dabei anfallende Phosphat verwerten können. Die Bakterien in ihrem Magen produzieren das Enzym Phytase, das den Abbau von Phytat zu Zucker und Phosphat ermöglicht.
Die Gülle der Wiederkäuer ist daher phosphatarm, im Gegensatz zu den Ausscheidungsprodukten anderer Nutztiere, die bei hohen Bestandsdichten ein ernsthaftes Entsorgungs- und Umweltproblem bedeuten können.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu PHYTIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 8. Februar 2021.
- ↑ a b c Datenblatt Phytic acid dipotassium salt bei Sigma-Aldrich, abgerufen am 14. Juni 2011 (PDF).
- ↑ Phytinsäure. In: Lexikon der Biochemie. Spektrum Akademischer Verlag, abgerufen am 27. Juni 2018.
- ↑ Hans-Dieter Belitz: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-662-08308-6, S. 368 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Zusatzstoffe in der EU (Stand Dezember 2011; PDF; 235 kB).
- ↑ Erläuterung von Tintenfraß und Gegenmaßnahmen im "Forum Bestandserhaltung" der Universität Münster mit Literaturangaben, zuletzt abgerufen am 25. September 2014.
- ↑ IADA Congress, zuletzt abgerufen am 10. Juni 2020.
- ↑ Andreas Hahn, Alexander Ströhle, Maike Wolters: Ernährung. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2006, ISBN 3-8047-2293-8.
- ↑ Phytic Acid 101: Everything You Need to Know. 28. Juni 2018, abgerufen am 13. Dezember 2021 (englisch).
- ↑ Referenzwerte für Zink. DGE, abgerufen am 10. Februar 2021.
- ↑ Phytic Acid 101: Everything You Need to Know. 28. Juni 2018, abgerufen am 13. Dezember 2021 (englisch).
- ↑ E. V. Shikh, A. A. Makhova, O. B. Dorogun, E. V. Elizarova: [The role of phytates in human nutrition]. In: Voprosy Pitaniia. Band 92, Nr. 4, 2023, S. 20–28, doi:10.33029/0042-8833-2023-92-4-20-28, PMID 37801451.
Literatur
[Bearbeiten | Quelltext bearbeiten]- B. F. Harland, D. Donald Oberleas: Effects of Dietary Fiber and Phytate on the Homeostasis and Bioavailability of Minerals. In: Gene A. Spiller (Hrsg.): CRC Handbook of Dietary Fiber in Human Nutrition. Third Edition. CRC Press, 2001, ISBN 0-8493-2387-8, S. 161–170.
- S. B. Shears: Assessing the omnipotence of inositol hexakisphosphate. In: Cell. Signal. 13(3), 2001, S. 151–158. PMID 11282453
- V. Raboy: myo-Inositol-1,2,3,4,5,6-hexakisphosphate. In: Phytochemistry 64(6), 2003, S. 1033–1043.
- A. R. Alcazar-Roman u. a.: Inositol hexakisphosphate and Gle1 activate the DEAD-box protein Dbp5 for nuclear mRNA export. In: Nat Cell Biol. 8(7), 2006, S. 711–716. PMID 16783363
- C. S. Weirich u. a.: Activation of the DExD/H-box protein Dbp5 by the nuclear-pore protein Gle1 and its coactivator InsP6 is required for mRNA export. In: Nat. Cell Biol. 8(7), 2006, S. 668–676. PMID 16783364