Polycaprolactam
| Strukturformel | |||
|---|---|---|---|

| |||
| Allgemeines | |||
| Name | Polycaprolactam | ||
| Andere Namen | |||
| CAS-Nummer | 25038-54-4 | ||
| Monomer | Caprolactam | ||
| Summenformel der Wiederholeinheit | C6H11NO | ||
| Molare Masse der Wiederholeinheit | 113,16 g·mol−1 | ||
| PubChem | 32775 | ||
| Art des Polymers | |||
| Eigenschaften | |||
| Aggregatzustand |
fest | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Polycaprolactam (Polyamid 6, Kurzzeichen PA6, bekannte Handelsmarke Perlon) ist ein Polymer aus der Gruppe der Polyamide. Polycaprolactam wurde erstmals 1938 von Paul Schlack (I.G. Farben) synthetisiert, um die Eigenschaften von Nylon 6,6 zu reproduzieren, ohne das geltende Produktionspatent zu verletzen.[3]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Polyamid 6 entsteht durch ringöffnende Polymerisation von ε-Caprolactam.
Hydrolytische Kettenpolymerisation: Für die Startreaktion wird ε-Aminocapronsäure benötigt. Sie wird durch hydrolytische Ringöffnung aus ε-Caprolactam gewonnen. Dazu werden geringe Mengen an Wasser zugesetzt:
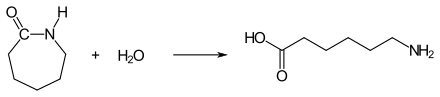
ε-Aminocapronsäure reagiert zusammen mit ε-Caprolactam unter Ausbildung von Amidbindungen zum Polycaprolactam:
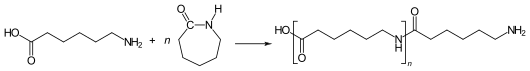
Die Kettenpolymerisation erfolgt unter Ringöffnung an die Amino-Endgruppe der wachsenden Kette.[4] In kontinuierlichen (VK-Rohr-Verfahren) oder diskontinuierlichen Verfahren erfolgt die Reaktion im Bereich von 260 bis 280 °C (VK-Rohr-Verfahren: 240 °C). Die Reaktionszeit beträgt 8 bis 10 Stunden. Verbleibende Monomere werden aus der Schmelze des Produkts im Vakuum entgast oder aus dem Granulat mit Wasser extrahiert.[5]
Anionische Kettenpolymerisation: Diese Polymerisation verläuft vergleichsweise kompliziert.[6] Zur Initiierung wird ε-Caprolactam mit Alkoholaten, primären oder sekundären Aminen in ein Anion überführt.
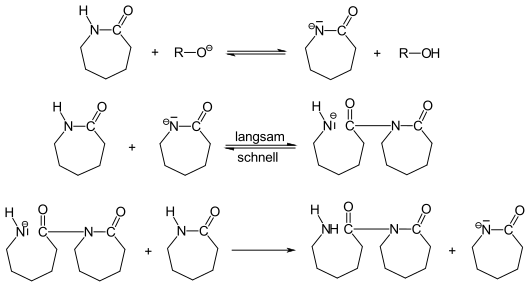
Es entsteht nach Addition von Caprolactam ein N-acyliertes Caprolactam, das eigentliche aktive Kettenende der Kettenwachstumsreaktion. Die Wachstumsreaktion erfolgt nach:

Die langsam verlaufende Bildung von aktiven Kettenenden kann mit Carbonsäurechloriden, Anhydriden oder Isocyanaten beschleunigt werden:

Unter Stickstoffatmosphäre erfolgt die exotherme Kettenpolymerisation bei 120 bis 150 °C innerhalb weniger Minuten.[5]
Polykondensation: Die Synthese von Polyamid 6 ist auch über eine Polykondensation von ε-Aminocapronsäure möglich:

Verwendung
[Bearbeiten | Quelltext bearbeiten]Polycaprolactam findet als Kunstfaser unter dem Namen Perlon Verwendung.[7] Viele gegossene (PA6G) und extrudierte (PA6E) Bauteile werden aus Polycaprolactam hergestellt. Der Kunststoff wird auf Grund der Zähigkeit und Verschleißfestigkeit im Maschinenbau für gering belastete Zahnräder und Schrauben sowie wegen der guten Gleiteigenschaften für hoch belastete Gleitlager und -platten verwendet.[8]
In der Dünnschicht- und Säulenchromatographie wird es als Trägermaterial (stationäre Phase) verwendet.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu NYLON-6 in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Helmut Ritter: Makromoleküle I: Von einfachen Chemierohstoffen zu Hochleistungspolymeren. Springer-Verlag, 2018, ISBN 978-3-662-55956-7, S. 6.
- ↑ Bernd Tieke, Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 117.
- ↑ a b Wolfgang Kaiser, Kunststoffchemie für Ingenieure, 3. Auflage, Carl Hanser, München, 2011, S. 363.
- ↑ Bernd Tieke, Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 112f.
- ↑ Karl-Heinz Lautenschläger, Werner Schröter: Taschenbuch der Chemie, Harri Deutsch Verlag, 2007, ISBN 978-3-817-11761-1.
- ↑ EUROPA Tabellenbuch Metall.
- ↑ Reinhard Matissek, Gabriele Steiner, Markus Fischer: Lebensmittelanalytik. 4. Auflage. Springer, Berlin 2010, ISBN 978-3-540-92205-6.