Rubidiumhydrogensulfid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
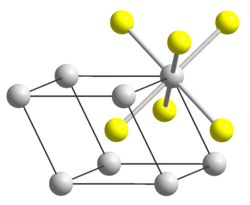
| |||||||
| _ Rb+ _ HS− | |||||||
| Kristallsystem |
rhomboedrisch | ||||||
| Raumgruppe |
R3m (Nr. 166) | ||||||
| Gitterparameter |
a = 453,0 pm, β = 69,3° | ||||||
| Allgemeines | |||||||
| Name | Rubidiumhydrogensulfid | ||||||
| Verhältnisformel | RbHS | ||||||
| Kurzbeschreibung |
weiße, zerfließliche Nadeln[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 118,54 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Rubidiumhydrogensulfid ist ein Rubidiumsalz der Schwefelwasserstoffsäure.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Rubidiumhydrogensulfid kann durch Einleiten von Schwefelwasserstoff in Rubidiumhydroxidlösung gewonnen werden.[3][1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Rubidiumhydrogensulfid kristallisiert im trigonalen Kristallsystem in der Raumgruppe R3m (Raumgruppen-Nr. 166) mit den Gitterparametern a = 453,0 pm, β = 69,3°, und 1 Formeleinheit pro Elementarzelle.[4] Bei 130 °C findet ein Phasenübergang in eine kubische Kristallstruktur mit dem Gitterparameter a = 692 pm, der Raumgruppe Fm3m (Nr. 225) und 4 Formeleinheiten pro Elementarzelle statt.[4]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mit stöchiometrischen Mengen Rubidiumhydroxid reagiert Rubidiumhydrogensulfid zu Rubidiumsulfid weiter.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c W. Blitz, E. Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr. f. anorg. Chem. 1906. 48, S. 297–317. Volltext
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 692f. (eingeschränkte Vorschau in der Google-Buchsuche).

