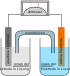
Redox-Flow-Batterie
Die Redox-Flow-Batterie (RFB) oder (Redox-)Flussbatterie – allgemeiner auch Flüssigbatterie oder Nasszelle genannt – ist eine Ausführungsform eines Akkumulators. Sie speichert elektrische Energie in chemischen Verbindungen, wobei die Reaktionspartner in einem Lösungsmittel in gelöster Form vorliegen. Die zwei energiespeichernden Elektrolyte zirkulieren dabei in zwei getrennten Kreisläufen, zwischen denen in der galvanischen Zelle mittels einer Membran der Ionenaustausch erfolgt. In der Zelle werden dabei die gelösten Stoffe chemisch reduziert bzw. oxidiert, wobei elektrische Energie frei wird.
Allgemeines
[Bearbeiten | Quelltext bearbeiten]Im Vergleich zu einem Akkumulator ohne Stoffaustausch liegt eine aufwändigere Konstruktion vor, die neben Tank und Rohrleitungen mindestens zwei Pumpen für die Umwälzung der Elektrolyte samt den dafür nötigen Steuer- und Kontrolleinrichtungen benötigt. Daher eignen sich Flussbatterien nicht für kleine Verbraucher. Der Einsatz im Bereich der Elektromobilität ist Thema von Forschungen. Der bisher am häufigsten eingesetzte und wichtigste Typ der Flussbatterie ist der Vanadium-Redox-Akkumulator. Darüber hinaus gibt es noch weitere Typen wie den Polysulfid-Bromid-Akkumulator, Natriumchlorid-Redox-Akkumulator, Zink-Brom-Akkumulator, Uran-Redox-Akkumulator[1] und als neuere Entwicklungen ein Akku auf der Basis von Lignin sowie der Bau eines Akkus mit einer Membran in flüssiger Form, mit welcher der Stromkollektor zwischen den beiden chemischen Verbindungen vereinfacht gebaut werden kann.
Da die in einem Lösungsmittel gelösten chemischen Verbindungen in von der Zelle getrennten und beliebig groß ausgeführten Tanks gespeichert werden, ist die gespeicherte Energiemenge nicht von der Zellengröße abhängig. Die Redox-Flow-Batterie ist durch die elektrochemische Reversibilität mit dem Akkumulator und der Reversiblen Brennstoffzelle verwandt. Die Zellenspannung ist durch die Nernst-Gleichung gegeben und liegt bei praktisch realisierbaren Systemen bei 1 V bis 2,2 V.
Forschung
[Bearbeiten | Quelltext bearbeiten]Geschichte
[Bearbeiten | Quelltext bearbeiten]Die grundlegenden Prinzipien ohne praktische Anwendungen sind seit den 1880er-Jahren bekannt.[2] Die Grundlagen für Redox-Flow-Zellen wurden Mitte des 20. Jahrhunderts in Deutschland von Walther Kangro an der Technischen Universität Braunschweig erarbeitet, als erstmals die Möglichkeiten der Energiespeicherung mit Redox-Paaren geprüft wurden.[3][4][5][6] In den 1970er Jahren beschäftigte sich die NASA mit der Entwicklung der Technik.[7][2] Die reine Vanadium-Lösung wurde 1978 erstmals vorgeschlagen und in den 1980ern an der University of New South Wales von Maria Skyllas-Kazacos und ihren Mitarbeitern entwickelt. Dieser Typ wurde 1986 patentiert und ist bisher am verbreitetsten. Sie erfuhr eine Weiterentwicklung zur Vanadium-Bromid-basierten Zelle, die eine doppelt so hohe Energiedichte erlaubt.
Neuere Forschung
[Bearbeiten | Quelltext bearbeiten]Im Januar 2014 stellten Forscher der Harvard University eine Redox-Flow-Zelle auf Basis von organischen Chinonen vor, die ohne Einsatz seltener und damit vergleichsweise teurer Substanzen auskommt. Bei Prototypen unter Laborbedingungen wurde eine Leistungsdichte von 600 mW/cm² gemessen. Es wurde weiters an der Langzeitstabilität solcher Zellen geforscht.[8][9]
Eine weitere Neuerung stellte 2015 die Friedrich-Schiller-Universität Jena vor, eine Polymer-basierte Redox-Flow-Batterie (pRFB), die vollständig auf Metalle als Aktivmaterial verzichtet. Diese neue Bauform setzt organische Polymere, ähnlich Plexiglas oder Styropor und die eine redoxaktive Einheit tragen, für die Anode und Kathode ein. Als Lösungsmittel werden keine korrosiven Säuren benötigt, sondern es kommt eine Kochsalzlösung zur Anwendung. Der Einsatz der wässrigen Polymerlösungen ermöglicht darüber hinaus die Nutzung von Dialysemembranen zur Trennung von Anode und Kathode, die einfacher und günstiger herstellbar sind als klassische Ionentauschermembranen. Während die großen Makromoleküle (Polymere) nach dem Prinzip eines „Siebes“ zurückgehalten werden, können die vergleichsweise kleinen Natriumionen und Chloridionen die Membran ungehindert passieren und den zellinternen Stromkreis schließen.[10] Aus Spanien stammte die Idee einer Flüssigmembran. Ein Startup baute in der Schweiz auf dieser Basis im Jahr 2024 eine Versuchsanlage in Thalwil.[2] Dieses Unternehmen Unbound Potential hatte 2022/23 auch Gelder aus der Bundesagentur für Sprunginnovationen erhalten.[11]
2018 wurde u. a. die Eignung von Lignin als Anolyt untersucht. Lignin gilt aufgrund seiner chemischen Eigenschaften in Kombination mit seiner Umweltfreundlichkeit, seiner weiten Verfügbarkeit und seiner niedrigen Kosten als vielversprechender Rohstoff für metallfreie Redox-Flow-Batterien zur Energiespeicherung. Im März 2018 wird über eine erzielte Stromdichte von 20 mA/cm² und einen Polarisationswiderstand von 15 Ω/cm² auf Basis von Ligninsulfonat unter Laborbedingungen berichtet.[12]
Im Oktober 2020 wurde von einer Forschergruppe der TU Graz das redoxaktive 2-Methoxyhydrochinon – durch Oxidation des aus Ligninsulfonat zugänglichen Vanillins erhältlich – als organischer Elektrolyt in einer wässrig-organischen RFB beschrieben. In 0,5 M Phosphorsäure (H3PO4 in H2O) als Lösungsmittel konnten über 250 Lade-Entlade-Zyklen ohne nennenswerte Effizienzeinbußen realisiert werden.[13][14][15] Ein technischer Test im Mürztal wurde mit Stand Februar 2024 getestet.[16] Ebenfalls 2020 wurde ein Redox-System auf Eisenbasis entwickelt.[17]
Im Jahre 2021 wurde über Forschungsarbeiten berichtet, welche ein System mit Mangan anstelle von Vanadium verwenden[18]
Im Jahr 2022 stellten Forscher der Utah State University einen Prototyp eines Redox-Flow-Systems mit einer Anode aus Viologenen vor, das eine Energiedichte von mehr als 40 Wh pro Liter Elektrolyt bei damaligen Kosten von unter 100 USD je kWh erreicht und nach 1000 Ladezyklen noch 100 % seiner Kapazität behalten soll.[19]
Technik
[Bearbeiten | Quelltext bearbeiten]
Aufbau
[Bearbeiten | Quelltext bearbeiten]Die energiespeichernden Elektrolyte werden außerhalb der Zelle in getrennten Tanks gelagert.[20] Damit ist die Redox-Flow-Zelle mit den Tanks für die Elektrolyte – wie die Brennstoffzelle mit den Tanks für den Brennstoff und das Oxidationsmittel – ein elektrochemischer Energiespeicher, bei dem Energiemenge und Leistung unabhängig voneinander skaliert werden können. Die Tanks könnten manuell befüllt und der Akkumulator somit durch einen Stoffwechsel geladen werden. Durch den Austausch der Elektrolytflüssigkeiten können diese auch in räumlich getrennten Akkumulatoren geladen und entladen werden; somit braucht nicht der gesamte Akkumulator mit Wandlertechnik und Gehäuse, sondern nur der eigentliche Energieträger zwischen der Lade- und Entladestation ausgetauscht zu werden. In der Praxis werden die Systeme aber mit möglichst geschlossenen Kreisläufen ausgeführt.
Die eigentliche galvanische Zelle wird durch eine Membran in zwei Halbzellen geteilt. An der Membran fließt der Elektrolyt vorbei. Die Halbzelle wird durch eine Elektrode abgegrenzt, an der die eigentliche chemische Reaktion in Form einer Reduktion oder Oxidation abläuft. Die Membran ist je nach Zelltyp ein mikroporöser Separator, der alle Ionen passieren lässt, eine selektive Anionen- oder Kationentauschermembran oder eine Größenausschlussmembran, die Polymer zurückhält und kleine Ionen passieren lässt. Die Membran soll die Vermischung der beiden Elektrolyte verhindern.
Die Elektroden bestehen aufgrund ihres hohen elektrochemischen Spannungsfensters in wässrigen Lösungen meistens aus Graphit. Für eine möglichst hohe spezifische Leistung werden als Elektrodenmaterial Graphitfilze mit hoher spezifischer Oberfläche eingesetzt.
Elektrolyt
[Bearbeiten | Quelltext bearbeiten]Der Elektrolyt besteht aus einem in Lösungsmittel gelösten Salz. Die Zusammensetzung des Elektrolytes, genauer die Konzentration, bestimmt maßgeblich mit der Zellenspannung die Energiedichte der Redox-Flow-Batterie. Als Lösungsmittel werden häufig entweder anorganische oder organische Säuren verwendet. In neueren Systemen, wie der polymerbasierten Batterie, können auch simple Kochsalzlösungen eingesetzt werden. Als verwendbare Redoxpaare kommen unter anderem Vanadium(V)-oxid (im Vanadium-Redox-Akkumulator), Natriumbromid (im Natriumbromid-Redox-Akkumulator) oder auch Eisen (IRFB) in Kombination mit weiteren chemischen Verbindungen zur Anwendung. Es kommen auch Verbindungen auf Basis organischer Stoffe wie Lignin[21][22], bzw. Ligninsulfonat-Lösungen in Frage.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Redox-Flow-Zelle kann je nach Baugröße und Typ Leistungen von einigen 100 Watt bis zu mehreren Megawatt bereitstellen und hat einen Wirkungsgrad im Bereich von 75 bis 80 Prozent. Zudem hat das System eine geringe Selbstentladung und eine hohe Standzeit. Letztere basiert darauf, dass das Elektrodenmaterial bei der Reaktion des Elektrolyten selbst chemisch nicht reagiert und damit nicht degeneriert. Demgegenüber ist die Energiedichte vergleichsweise gering; üblicherweise sind beim Vanadium-Redox-Akkumulator auf Sulfatbasis ca. 25 Wh pro Liter Elektrolytflüssigkeit, auf Bromidbasis ca. 50 Wh pro Liter Elektrolytflüssigkeit zu erzielen.[23] Unter idealen Laborbedingungen können auch geringfügig höhere Werte erreicht werden.
Dieselkraftstoff weist mit ca. 10 kWh pro Liter eine ca. 400-fache Energiedichte gegenüber dem Elektrolyt von Vanadium-Redox-Akkumulatoren auf, handelsübliche Bleiakkumulatoren erzielen eine Energiedichte von rund 42 Wh/kg, bezogen auf die gesamte Masse des Akkumulators.[24] Bezogen nur auf den Elektrolyt des Bleiakkumulators, der ca. 50 % des Akkus ausmacht, ergibt sich ein Wert um 80 Wh pro Liter Elektrolytflüssigkeit bei einem Bleiakkumulator. Im Vergleich zu einem Pumpspeicherwerk mit einer auf eine Höhendifferenz von 100 m normierten Energiedichte von 0,272 Wh/(l 100m) ist die Energiedichte jedoch deutlich höher.
In der folgenden Tabelle wurden einige Redox-Flow-Batterietypen mit der Zellspannung und der Energiedichte pro Liter Elektrolytflüssigkeit zusammengestellt:
| Type | Zellspannung (V) | Energiedichte pro Liter Elektrolytflüssigkeit (Wh/l) |
|---|---|---|
| Vanadium-Redox-Akkumulator | 1,25 | 15 – 25 |
| Polysulfid-Bromid-Akkumulator | 1,54 | 25 – 50 |
| Zink-Brom-Akkumulator | 1,85 | 50 – 80 |
Beispielhafte Anwendungen
[Bearbeiten | Quelltext bearbeiten]Redox-Flow-Batterien eignen sich zur Nutzung als stationäre Batteriespeicher. Sie werden in Pilotprojekten etwa in Form des Vanadium-Redox-Akkumulators als Reservequelle für Mobilfunk-Basisstationen oder Pufferbatterie für Windkraftanlagen eingesetzt.
Ein Redox-Flow-Batterie mit 4 MW Leistung und einer Speicherfähigkeit von 6 MWh wird seit 2012 in einer japanischen Windkraftanlage eingesetzt.[25]
Der Vanadium-Redox-Akkumulator des Hybridkraftwerks Pellworm hat eine Speicherfähigkeit von 1,6 MWh und eine Lade-/Entladeleistung von 200 kW[26]. Diese Testanlage war für die Versorgung von rund 600 Haushalten ausgelegt.[27]
In einem praxisnahen Forschungsprojekt (Applikationszentrum) erforscht das Fraunhofer ICT in Pfinztal seit Ende September 2018 die Pufferung stark schwankender Windenergie einer 2-MW-Windkraftanlage mit einer 20-MWh-Redox-Flow-Batterie. Zusätzlich wird bis 2021 eine 500-kW-Solaranlage installiert.[28] Ziel ist es, eine kontinuierliche Stromversorgung der Stromverbraucher zu den Hauptbedarfszeiten zu erreichen.[29] Eine Sonderanwendung stellt das Flow Battery Research Collective (FBRC) dar, welches gemeinsam mit dem FAIR Battery Project als Open-Source-Hardware dokumentierte und unter CERN-OHL lizenzierte Redox-Flow-Batterien bietet.[30][31][32]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Energy-2.0-Fachbericht ( vom 21. Februar 2013 im Webarchiv archive.today)
- RWTH Aachen, ISEA – Redox-Flow-Batteriesysteme ( vom 2. November 2011 im Internet Archive)
- Redox-Flow-Batterien bei der Fraunhofer-Gesellschaft
- Redox Flow Cell Development and Demonstration Project (PDF), NASA, 1977
- Eine gigantische Batterie im Untergrund. Spektrum der Wissenschaft, 24. September 2018.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Yoshinobu Shiokawa, Hajimu Yamana, Hirotake Moriyama: An Application of Actinide Elements for a Redox Flow Battery. In: Journal of Nuclear Science and Technology. Band 37, Nr. 3, 2000, S. 253–256, doi:10.1080/18811248.2000.9714891.
- ↑ a b c ETH Spin-Off baut Superbatterie, SRF 10 vor 10, 19. Juli 2024
- ↑ Patent DE914264: Verfahren zur Speicherung von elektrischer Energie. Angemeldet am 28. Juni 1949, veröffentlicht am 28. Juni 1954, Anmelder: Walther Kangro, Braunschweig, Erfinder: Walther Kangro, Braunschweig.
- ↑ Heinz Pieper: Zur Frage der Speicherung von elektrischer Energie in Flüssigkeiten. In: Dissertation Technische Hochschule Braunschweig. Braunschweig 1958, OCLC 64523955.
- ↑ W. Kangro, H. Pieper: Zur Frage der Speicherung von elektrischer Energie in Flüssigkeiten. In: Electrochimica Acta. Band 7, Nr. 4, 1962, S. 435 bis 448, doi:10.1016/0013-4686(62)80032-2.
- ↑ Patent DE1006479: Verfahren zur Speicherung von elektrischer Energie in Flüssigkeiten. Angemeldet am 14. Juli 1954, veröffentlicht am 18. April 1957, Anmelder: Walther Kangro, Braunschweig, Erfinder: Walther Kangro, Braunschweig (beschreibt die Verwendung von Mehrfachelektroden, bei denen beim Laden andere Teile als beim Entladen verwendet werden. Das Patent ist für die weitere Entwicklung der Redox-Flow-Zellen nicht sehr bedeutsam, belegt aber, dass sich Kangro um eine Weiterentwicklung bemüht hat.).
- ↑ Patent US3996064: Energy storage system. Angemeldet am 22. August 1975, veröffentlicht am 7. Dezember 1976, Anmelder: NASA, Erfinder: Lawrence H. Thaller.
- ↑ Organic mega flow battery promises breakthrough for renewable energy. Internetseite der Harvard University. Abgerufen am 10. Januar 2014.
- ↑ Brian Huskinson u. : A metal-free organic––inorganic aqueous flow battery. In: Nature. 505, (2014), 195–198, doi:10.1038/nature12909.
- ↑ Tobias Janoschka, Norbert Martin, Udo Martin, Christian Friebe, Sabine Morgenstern, Hannes Hiller, Martin D. Hager, Ulrich S. Schubert: An aqueous, polymer-based redox-flow battery using non-corrosive, safe, and low-cost materials. In: Nature. (2015), doi:10.1038/nature15746.
- ↑ 05 - Progress for Sustainability ( vom 22. Mai 2024 im Internet Archive), Internetauftritt von Unbound Potential
- ↑ Alolika Mukhopadhyay et al.: Metal-Free Aqueous Flow Battery with Novel Ultrafiltered Lignin as Electrolyte. In: ACS Sustainable Chemistry & Engineering. Band 6, Nr. 4, März 2018, S. 5394–5400, doi:10.1021/acssuschemeng.8b00221.
- ↑ Werner Schlemmer, Philipp Nothdurft, Alina Petzold, Gisbert Riess, Philipp Frühwirt, Max Schmallegger, Georg Gescheidt-Demner, Roland Fischer, Stefan A. Freunberger, Wolfgang Kern, Stefan Spirk: 2-Methoxyhydroquinone from Vanillin for Aqueous Redox-Flow Batteries. In: Angew. Chem. Int. Ed. Band 59, 2020, S. 1–5, doi:10.1002/anie.202008253.
- ↑ TU Graz: Mit Vanillin Energie speichern. 1. Oktober 2020, abgerufen am 5. Februar 2024 (österreichisches Deutsch).
- ↑ Das Vanillekipferl unter den Energiespeichern. 2. November 2023, abgerufen am 5. Februar 2024 (österreichisches Deutsch).
- ↑ Batterie mit Vanillin soll im Mürztal getestet werden. 5. Februar 2024, abgerufen am 5. Februar 2024 (österreichisches Deutsch). – Kostenlos nur teilweise einsehbar.
- ↑ Eisen-Redox-Flow Technik: Forscher entwickeln umweltfreundliche Stromspeicher für Wohnhäuser. Abgerufen am 21. Mai 2021 (deutsch).
- ↑ Maximilian Schmucker, Tyler A. Gully, Alexei Schmidt, Benjamin Schmidt, Kolja Bromberger: Investigations toward a Non-Aqueous Hybrid Redox-Flow Battery with a Manganese-Based Anolyte and Catholyte. In: Advanced Energy Materials. n/a, n/a, ISSN 1614-6840, S. 2101261, doi:10.1002/aenm.202101261 (wiley.com [abgerufen am 3. Juni 2021]).
- ↑ US-Forscher entwickeln Redox-Flow-Batterie auf Basis von Viologenen – pv magazine Deutschland. In: pv-magazine.de. 16. Februar 2022, abgerufen am 20. Juni 2022.
- ↑ L. F. Arenas, C. Ponce de León, F. C. Walsh: Engineering aspects of the design, construction and performance of modular redox flow batteries for energy storage. In: Journal of Energy Storage. Band 11, Juni 2017, S. 119–153, doi:10.1016/j.est.2017.02.007 (sciencedirect.com [abgerufen am 2. Juni 2017]).
- ↑ Katja Maria Engel: Eine gigantische Batterie im Untergrund. Spektrum der Wissenschaft, 24. September 2018, abgerufen am 2. Februar 2019.
- ↑ Organische Elektrolyte – Die Natur als Vorbild. Abgerufen am 18. Februar 2019.
- ↑ Redox-Flow-Batterien. In: carmen-ev.de. Archiviert vom (nicht mehr online verfügbar) am 9. August 2014; abgerufen am 27. Juli 2014.
- ↑ PS and PSG General Purpose Battery Specifications. Archiviert vom (nicht mehr online verfügbar) am 29. Dezember 2018; abgerufen am 1. Januar 2014.
- ↑ Andrew Stiel, Maria Skyllas-Kazacos: Feasibility Study of Energy Storage Systems in Wind/Diesel Applications Using the HOMER Model. In: Applied Sciences. Band 2, Nr. 4, Dezember 2012, ISSN 2076-3417, S. 726–737, doi:10.3390/app2040726 (mdpi.com [abgerufen am 3. Mai 2022]).
- ↑ euwid-energie.de: SmartRegion Pellworm testet Wirtschaftlichkeit von Speichern ( vom 17. Mai 2021 im Internet Archive) 2017-06-28
- ↑ The smarter E. Global: ees Europe Partner Enerox. Abgerufen am 14. Dezember 2022 (englisch).
- ↑ Stromspeicher dringend nötig – Fraunhofer-Institut rüstet auf.
- ↑ Energie im Tank. In: Fraunhofer-Gesellschaft. 20. Dezember 2018, abgerufen am 12. Oktober 2019.
- ↑ Sanli Faez: SanliFaez/FAIR-Battery. In: GitHub. 18. Juni 2024, abgerufen am 18. Juni 2024 (englisch).
- ↑ Flow Battery Research Collective. Abgerufen am 18. Juni 2024 (englisch).
- ↑ Building an Open-Source Hardware Flow Battery Development Kit. In: Codeberg. Abgerufen am 18. Juni 2024 (englisch).