Amiodaron
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Amiodaron | |||||||||||||||||||||
| Andere Namen |
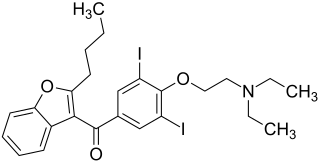
(2-Butylbenzofuran-3-yl)-[4-(2-diethylaminoethoxy)-3,5-diiod-phenyl]-methanon (IUPAC) | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
Klasse-III Antiarrhythmikum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
156 °C (Amiodaronhydrochlorid)[1] | |||||||||||||||||||||
| pKS-Wert |
6,56 (25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
| Verteilungsvolumen | 20 bis 200 L/kg |
| Fettlöslichkeit | sehr hoch |
| Plasmahalbwertszeit | 4,8 bis 68,2 Stunden |
| Eliminationshalbwertszeit | 13 bis 103 Tage |
| Elimination | Leber 99 % |
| Plasmaeiweißbindung | 95 % |
| Bioverfügbarkeit | 20–80 % |
| Übliche Initialdosis | 600–1400 mg/Tag |
| Kumulative Ladedosis | 10–12 g in 3–4 Wochen |
| Erhaltungsdosis | 200 mg |
Amiodaron ist ein Arzneistoff, der als Antiarrhythmikum zur Behandlung von zahlreichen Herzrhythmusstörungen eingesetzt wird. Amiodaron ist ein sehr wirksames Medikament gegen tachykarde Herzrhythmusstörungen, ist allerdings auch mit schwerwiegenden Nebenwirkungen behaftet.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Amiodaron, ein Benzofuran-Derivat, hat strukturelle Ähnlichkeiten mit Thyroxin und Procainamid. Ursprünglich war es aufgrund seiner Fähigkeit, periphere und koronare Arterien zu erweitern, seit 1961 in Belgien zur Behandlung der Angina Pectoris entwickelt worden, bis zufällig entdeckt wurde, dass es eine außerordentlich hemmende Wirkung auf ventrikuläre und supraventrikuläre Herzrhythmusstörungen hat. Selbst beim Einsatz bei Patienten mit schwerer Pumpfunktionsstörung der linken Herzkammer kommt es kaum zu einer Verschlechterung der Herzleistung, obwohl das Medikament eine mäßige negativ inotrope Wirksamkeit besitzt.[4] Seine extreme Löslichkeit in Fettgewebe bewirkt das außerordentlich hohe Verteilungsvolumen und ist auch für die lange und individuell sehr variable Halbwertszeit von 30 bis weit über 100 Tagen verantwortlich.
Wirkungsweise
[Bearbeiten | Quelltext bearbeiten]Amiodaron ist ein Antiarrhythmikum mit komplexer Wirkungsweise, die im Einzelnen noch nicht vollständig verstanden wird. Aufgrund seiner Eigenschaft, die Refraktärzeit und das Aktionspotential des Herzmuskelgewebes zu verlängern, wird es zwar wie etwa Sotalol der Klasse III nach Vaughan Williams (vgl. Antiarrhythmikum) mit einer starken Hemmung der Kaliumkanäle zugeordnet, aber es besitzt auch eine mäßig stark hemmende Wirkung auf α-, β- (Klasse II) und muskarinartige Rezeptoren und hat eine gewisse blockierende Wirkung sowohl auf schnelle und mittlere Natrium- (Klasse IA und IB) als auch Calciumkanäle (Klasse IV). Mit allen bekannten Antiarrhythmika teilt es die Fähigkeit, selbst Herzrhythmusstörungen auslösen zu können. Während dies allerdings seltener als bei anderen Antiarrhythmika vorkommt, ist hingegen vergleichsweise oft mit schwerwiegenden unerwünschten Wirkungen außerhalb des Herzens zu rechnen. Amiodaron wirkt zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[5]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Gesundheitsbehörde der USA empfiehlt Amiodaron wegen seiner hohen Toxizität nur[6] bei lebensbedrohlichen ventrikulären Arrhythmien, die nicht auf andere Therapiemaßnahmen ansprechen. Die langsam-intravenöse Dosierung[7] beträgt dabei 5 mg/kg bzw. 300 mg bei Erwachsenen, ggf. gefolgt von einer Dauerinfusion mit 10 bis 20 mg/kg/24 Stunden.
In Deutschland[8] gilt die Zulassung für
- symptomatische und behandlungsbedürftige tachykarde supraventrikuläre Herzrhythmusstörungen wie
- AV-junktionale Tachykardie (AV-Knoten-Reentrytachykardie),
- supraventrikuläre Tachykardie bei WPW-Syndrom oder
- (paroxysmales) Vorhofflimmern und -flattern sowie
- schwerwiegende symptomatische tachykarde ventrikuläre Herzrhythmusstörungen
- bei Patienten, „bei denen der Einsatz anderer Antiarryhthmika nach ärztlichem Ermessen nicht vertretbar ist“.
Es ist bislang das Mittel der ersten Wahl[9] bei Patienten mit Kammertachykardien oder Kammerflimmern im Rahmen einer Reanimation[10] sowie bei Patienten mit struktureller Herzerkrankung mit hochgradig eingeschränkter Pumpfunktion, wenn kein Defibrillator (ICD) implantiert werden kann.
Patienten mit struktureller Herzerkrankung (wie Infarktnarbe oder verminderter Pumpfunktion) können Amiodaron zur Stabilisierung des Sinusrhythmus nach erfolgreicher Kardioversion eines Vorhofflimmerns erhalten. Die orale oder intravenöse Verabreichung von Amiodaron kann Vorhofflimmern beenden, jedoch ist dies weder so zuverlässig noch verträglich wie die elektrische Kardioversion durch einen Elektroschock unter Kurznarkose.
Gegenanzeigen und Anwendungsbeschränkungen
[Bearbeiten | Quelltext bearbeiten]Vorsicht ist geboten bei bradykarden Herzrhythmusstörungen, Unverträglichkeit gegen Iodverbindungen oder (auch latente) Überfunktion der Schilddrüse.
Bei einer Verlängerung der QT-Zeit im EKG über 25 % der Norm oder über 500 ms muss, da Amiodaron selbst die QT-Zeit verlängert, mit gefährlichen Herzrhythmusstörungen gerechnet und die Behandlung ggf. beendet werden. Bei Erregungsleitungsstörungen darf Amiodaron nur unter Schutz eines Herzschrittmachers und auf einer Intensivstation angewandt werden.
Bei Möglichkeit einer Schwangerschaft ist Amiodaron nicht anwendbar. Frauen im gebärfähigen Alter müssen während der Therapie eine sichere Empfängnisverhütung betreiben.[11]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Während Amiodaron nach seiner Einführung zunächst als gut verträgliches und „ideales Antiarrhythmikum“ gefeiert wurde, stellten sich erst im Laufe der Zeit die zahlreichen unerwünschten Wirkungen von teilweise lebensbedrohlichen Ausmaßen heraus.
Lunge
[Bearbeiten | Quelltext bearbeiten]Die schwerste Nebenwirkung besteht in der Entwicklung einer tödlichen interstitiellen Lungenfibrose, die häufiger bei Patienten mit vorgeschädigtem Lungengewebe aufzutreten scheint. Bei etwa 5 % der behandelten Patienten kommt es zu dieser Entzündung der Lungenbläschen mit Vermehrung von Bindegewebe, was als fibrosierende Alveolitis bezeichnet wird. Schon nach einer Behandlungsdauer von wenigen Monaten wurde diese Nebenwirkung beobachtet. Neben den pharmakologischen Eigenschaften von Amiodaron, das durch seine ausgeprägte Hemmung der Phospholipase der Lunge zu einer Anhäufung von Surfactantphospholipiden führt, wird noch eine besondere genetische Empfänglichkeit für die Lungenfibrose vermutet.[12] Wenn die Fibrose in ihrem Vorstadium, der so genannten Pneumonitis, rechtzeitig erkannt wird, ist sie vollständig reversibel. Daher muss in regelmäßigen Abständen nach ihr gefahndet werden. Wiederholte Röntgenaufnahmen des Brustkorbs sind hierzu geeignet. Auch Funktionsuntersuchungen der Lunge werden empfohlen, werden aber erst im fortgeschrittenen Verlauf auffällig. Am spezifischsten für eine Amiodaron-bedingte Schädigung gilt eine dramatisch verminderte Diffusionskapazität der Lunge (DLCO im Lungenfunktionstest).
Amiodaron wurde auch kausal mit Pleuraerguss in Verbindung gebracht.[13]
Schilddrüse
[Bearbeiten | Quelltext bearbeiten]Wegen des hohen Iodgehaltes des Medikaments (37 % Iod) kommt es zu Schilddrüsenfunktionsstörungen. Amiodaron-induzierte Hypothyreosen kommen dabei bei Patienten vor, bei denen große Iodmengen eine inhibitorische Wirkung erzeugen.[14] Diesen Effekt machte man sich zur Behandlung der Hyperthyreose im Rahmen des Plummern zunutze. Über- oder Unterfunktionen der Schilddrüse findet man bei bis zu 40 % der Langzeitbehandelten. Die Schilddrüsenfunktion sollte halbjährlich durch eine TSH-Messung überwacht werden. Es kommt relativ häufig zu einem Absinken des biologisch deutlich stärker wirksamen fT3 in hypothyreote Bereiche, ohne dass klinisch eine Hypothyreose vorliegen muss. Grund hierfür ist eine Konversionsstörung bei der Umwandlung von fT4 in fT3, die sich in einer verminderten Summenaktivität peripherer Deiodasen ausdrückt. Amiodaron blockiert teilweise die für diesen Vorgang verantwortlichen Deiodasen. Die alleinige Bestimmung des freien Thyroxin FT4 gilt im Fall der Amiodaron-Thyreopathie als unzuverlässig.
Die gefürchtetste Nebenwirkung ist die Amiodaron-induzierte Thyreotoxikose (AIT), eine Störung des Stoffwechsels durch eine Funktionsstörung der Schilddrüse, die in schweren Fällen tödlich verlaufen kann. Sie beruht auf zwei verschiedenen Mechanismen (siehe Tabelle).[14] Ihre Gefährlichkeit ist unter anderem in der Tatsache begründet, dass das vorgeschädigte Herz von Patienten, die mit Amiodaron behandelt werden, eine besonders geringe Toleranz für eine hyperthyreote Stoffwechsellage aufweist.
| AIT Typ 1 | AIT Typ 2 | |
|---|---|---|
| Auftreten | früh (Wochen) | spät (Monate) |
| Vorbestehende Schilddrüsenerkrankung | häufig (z. B. Autonomie oder Morbus Basedow) | selten |
| Mechanismus | Vermehrte Bildung von Schilddrüsenhormonen | Vermehrte Freisetzung von Schilddrüsenhormonen |
| Iod- oder Technetium-Uptake | vermehrt | vermindert |
| Interleukin-6-Spiegel | normal | erhöht |
| Verlauf | schwer | mild bis schwer |
| Absetzen von Amiodaron | erforderlich | nicht erforderlich |
| Therapie | Perchlorat, Thyreostatika, Operation | Steroide |
Auge
[Bearbeiten | Quelltext bearbeiten]Mikroablagerungen in der Hornhaut des Auges finden sich bei mehr als 90 % der Patienten, die das Medikament seit mehr als einem halben Jahr einnehmen (Cornea verticillata, auch Vortexkeratopathie genannt). Die Einlagerungen können durch eine Spaltlampenuntersuchung zuverlässig durch den Augenarzt erkannt werden. 1 bis 10 % der Patienten geben einen leichten Blaustich in ihrer visuellen Wahrnehmung an. Die Hornhautablagerungen sollten nur bei ausgeprägten Sehbehinderungen zum Absetzen des Medikamentes führen. Manchen Kardiologen gilt die Keratopathie jedoch eher als Hinweis auf die zuverlässige Einnahme des Medikamentes und nicht als eine bedeutsame Nebenwirkung. 1 bis 2 % der Patienten erleiden allerdings eine optische Neuropathie mit Gesichtsfeldausfällen, die zum Absetzen des Medikamentes zwingen.
Magen-Darm-Trakt
[Bearbeiten | Quelltext bearbeiten]Rund die Hälfte der Patienten zeigt eine reversible Erhöhung der Leberenzyme als Zeichen eines Leberzellschadens. Diese kann trotz weiterer Einnahme des Medikaments wieder verschwinden. In sehr seltenen Fällen kann Amiodaron zum Bild einer akuten Hepatitis oder eines chronischen Leberschadens bis zur Leberzirrhose führen. Die durch Amiodaron verursachte Zirrhose erscheint lichtmikroskopisch ähnlich der Alkoholzirrhose. Die Unterscheidung kann durch Elektronenmikroskopie gestellt werden.[15]
Haut
[Bearbeiten | Quelltext bearbeiten]Sonnenexponierte Haut kann sich bei hellhäutigen Menschen aschgrau oder bläulich verfärben. Die Hautverfärbung kann nach Absetzen des Medikamentes verblassen, normalisiert sich jedoch nicht immer vollständig.
Eine vermehrte Lichtempfindlichkeit der Haut als Reaktion gegen UV-A-Strahlen kann versuchsweise durch entsprechende Cremes gemindert werden.
Nervensystem
[Bearbeiten | Quelltext bearbeiten]Das Medikament kann zu einer demyelinisierenden Polyneuropathie führen, welche klinisch fast nicht von anderen demyelinisierenden Neuropathien zu unterscheiden ist.
Das Medikament kann zu Schlafstörungen (schlechte Träume bis zu Albträume) führen. Die Häufigkeit wird mit „häufig“ angegeben.
Überwachungsparameter
[Bearbeiten | Quelltext bearbeiten]Serielle Laboruntersuchungen auf Amiodaron-bedingte Nebenwirkungen sind teuer und von beschränktem Wert. Zu Behandlungsbeginn ist es aber sinnvoll, das Blutbild und andere Blutuntersuchungen durchzuführen, ebenso Funktion von Schilddrüse und Lunge zu testen und eine augenärztliche Spaltlampenuntersuchung vornehmen zu lassen. Die ärztliche Aufmerksamkeit sollte auf die bei eventuellen Nebenwirkungen zu erwartende klinische Symptomatik gerichtet sein: Reizhusten, lastabhängige Atemnot, Sehstörungen, Abgeschlagenheit und Hautveränderungen geben Anlass zur weiteren Diagnostik.
Hemmung der Vitamin-A-Aufnahme
[Bearbeiten | Quelltext bearbeiten]Amiodaron hemmt das Enzym Retinylester-Hydrolase sowohl in der Leber als auch im Darm gemäß einer Studie an Ratten. Länger dauernde Einnahme erzeugt daher einen künstlichen Vitamin-A-Mangel, der auch durch Zufuhr des Vitamins nicht behoben werden kann.[16]
Wechselwirkung
[Bearbeiten | Quelltext bearbeiten]Amiodaron kann andere Medikamente in ihrer Wirkung nachhaltig verstärken – und umgekehrt. Bei vielen Antiarrhythmika ist dies der Fall, was zur kritischen Verlangsamung der Herzfrequenz oder umgekehrt zu den gefürchteten Torsade-de-pointes-Tachykardien führen kann. Spontane Blutungen können auftreten, wenn die Wirkung von Cumarin durch Amiodaron verstärkt wird.
Die Aufsättigung mit Amiodaron führt durchschnittlich über eine Interaktion über das Cytochrom P450 2D6 zu einer Verdopplung der Plasmaspiegel des Betablockers Metoprolol.[17]
Umgekehrt kann die Einnahme von Grapefruitsaft über eine komplette Hemmung der N-Desethylamiodaron-Produktion die Plasmakonzentration von Amiodaron erheblich erhöhen.[18]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Amiodares (D), Amiogamma (D), Cordarex (D), Cordarone (CH), Cornaron (D), Escordaron (CH), Sedacoron (A), diverse Generika (D, A, CH)[19][20][21]
Literatur
[Bearbeiten | Quelltext bearbeiten]- R. L. Woosley, J. H. Indik: Antiarrhythmic Drugs. In: V. Fuster, W. Alexander, R. A. O’Rourke (Hrsg.): Hurst’s The Heart. 11. Auflage. McGraw-Hill, New York 2004, ISBN 0-07-142264-1, S. 949–973.
- L. A. Siddoway: Amiodarone: Guidelines for Use and Monitoring. In: American Family Physician. Dec. 1, 2003. (Volltext in Englisch)
- P. J. Kudenchuk, L. A. Cobb, M. K. Copass, R. O. Cummins, A. M. Doherty, C. E. Fahrenbruch, A. P. Hallstrom, W. A. Murray, M. Olsufka, T. Walsh: Amiodarone for resuscitation after out-of-hospital cardiac arrest due to ventricular fibrillation. In: The New England Journal of Medicine. 341(12), 1999 Sep 16, S. 871–878. PMID 10486418.
- T. Guarnieri, S. Nolan, S. O. Gottlieb, A. Dudek, D. R. Lowry: Intravenous amiodarone for the prevention of atrial fibrillation after open heart surgery: the Amiodarone Reduction in Coronary Heart (ARCH) trial. In: J Am Coll Cardiol.34(2), 1999, Aug, S. 343–347. PMID 10440143.
- Anne Paschen: Herz. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 185–283, hier: S. 263–265 (Amiodaron).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 81.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-89.
- ↑ a b c Datenblatt Amiodarone hydrochloride, ≥98% bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- ↑ M. H. Crawford, J. P. DiMarco, W. J. Paulus (Hrsg.): Cardiology. 2. Auflage. Mosby, Edinburgh 2004, ISBN 0-323-02405-X, S. 603.
- ↑ J. Kornhuber, M. Muehlbacher, S. Trapp, S. Pechmann, A. Friedl, M. Reichel, C. Mühle, L. Terfloth, T. Groemer, G. Spitzer, K. Liedl, E. Gulbins, P. Tripal: Identification of Novel Functional Inhibitors of Acid Sphingomyelinase. In: PLoS ONE. Band 6, Nr. 8, 2011, S. e23852, doi:10.1371/journal.pone.0023852.
- ↑ R. L. Woosley, J. H. Indik: Antiarrhythmic Drugs. In: V. Fuster, W. Alexander, R. A. O’Rourke (Hrsg.): Hurst’s The Heart. 11. Auflage. McGraw-Hill, New York 2004, ISBN 0-07-142264-1, S. 949–973.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 76 f.; hier: S. 77.
- ↑ Bundesverband der Pharmazeutischen Industrie e. V. (BPI), Verband Forschender Arzneimittelhersteller e. V. (VFA), Bundesfachverband der Arzneimittel-Hersteller e. V. (BAH), Deutscher Generikaverband e. V. (Hrsg.): Rote Liste 2006. Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt am Main 2006, ISBN 3-939192-00-7.
- ↑ C. Mewis, R. Riessen, I. Spyridopoulos (Hrsg.): Kardiologie compact. Alles für Station und Facharztprüfung. Georg Thieme Verlag, Stuttgart / New York 2004, ISBN 3-13-130741-2, S. 782–783.
- ↑ S. G. Priori, E. Aliot, C. Blomstrom-Lundqvist, L. Bossaert, G. Breithardt, P. Brugada, A. J. Camm, R. Cappato, S. M. Cobbe, C. Di Mario, B. J. Maron, W. J. McKenna, A. K. Pedersen, U. Ravens, P. J. Schwartz, P. Trusz-Gluza, P. Vardas, H. J. J. Wellens, D. P. Zipes: Task Force on Sudden Cardiac Death of the European Society of Cardiology. In: Eur Heart J. 22(16), 2001 August 2, S. 1374–1450. PMID 11482917.
- ↑ Ernst Mutschler, Gerd Geislinger, Heyo K. Kroemer, Sabine Menzel, Peter Ruth: Mutschler Arzneimittelwirkungen – Pharmakologie, Klinische Pharmakologie, Toxikologie. 10. Auflage. Stuttgart 2013, S. 558.
- ↑ W. Seeger: Erkrankungen der Atmungsorgane. In: Jürgen Schölmerich u. a.: Medizinische Therapie 2005/2006. 2. Auflage. Springer, Berlin / Heidelberg / New York 2005, ISBN 3-540-21226-4, S. 1005.
- ↑ Berthold Jany, Tobias Welte: Pleuraerguss des Erwachsenen – Ursachen, Diagnostik und Therapie. In: Deutsches Ärzteblatt. Band 116, Nr. 21, (Mai) 2019, S. 377–385, hier: S. 380.
- ↑ a b George J. Kahaly, Markus Dietlein, Roland Gärtner, Klaus Mann, Henning Dralle: Amiodaron und Schilddrüsendysfunktion, Amiodarone-Induced Thyroid Dysfunction. In: Deutsches Ärzteblatt. 104(51–52), 2007, S. A-3550 / B-3129 / C-3021.
- ↑ Jules L. Dienstag: Toxic and Drug-Induced Hepatitis. In: Anthony Fauci u. a.: Harrison’s Principles of Internal Medicine. 17. Auflage. New York 2007, S. 1953.
- ↑ R. Schindler, T. Fielenbach, G. Rave: A comparative study on the effects of oral amiodarone and trimeprazine, two in vitro retinyl ester hydrolase inhibitors, on the metabolic availability of vitamin A in rats. In: Br. J. Nutr. Band 94, Nr. 5, November 2005, S. 675–683, PMID 16277768.
- ↑ D. Werner, H. Wuttke, M. F. Fromm, S. Schaefer, T. Eschenhagen: Effect of amiodarone on the plasma levels of metoprolol. In: Am J Cardiol. 94(10), 15. November 2004, S. 1319–1321. doi:10.1016/j.amjcard.2004.07.125.
- ↑ Christian C Libersa et al.: Dramatic inhibition of amiodarone metabolism induced by grapefruit juice. In: British Journal of Clinical Pharmacology. 2000 Apr; 49(4), S. 373–378. doi:10.1046/j.1365-2125.2000.00163.x.
- ↑ Rote Liste Online, Stand: April 2017.
- ↑ Eintrag zu Cordarone. In: Arzneimittelkompendium der Schweiz; abgerufen am 22. April 2018.
- ↑ AGES-PharmMed, Stand: August 2009.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- ATC-C01
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Gesundheitsschädlicher Stoff bei Einatmen
- Hautreizender Stoff
- Augenreizender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Iodbenzol
- Alkylamin
- Ethoxybenzol
- Benzofuran
- Antiarrhythmikum
- Notfallmedikament
- Arzneistoff
- Diarylketon