Acetale
| Acetale |
 |
 |
Acetale sind chemische Verbindungen mit zwei Alkoxy- oder Aryloxygruppen (–OR) am selben Kohlenstoff-Atom. Damit zählen sie zu den geminalen Diethern. Die Bezeichnung für diese Stoffgruppe geht auf Acetaldehyddiethylacetal zurück, das anfangs einfach Acetal genannt wurde.
Acetale leiten sich formal von Aldehyden bzw. Ketonen ab, wobei ursprünglich zwischen den aus Aldehyden gebildeten Diethern (mit einem H-Atom) und den aus Ketonen gebildeten Diethern (Ketalen) unterschieden wurde. Heutzutage werden nach IUPAC Ketale meist als Unterklasse der Acetale betrachtet.[2][3]
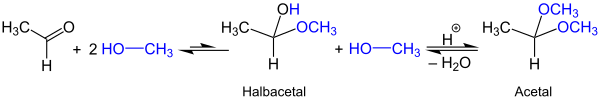
Bei der Bildung von Acetalen entstehen als Zwischenprodukte die Semi- bzw. Halbacetale, die in Anwesenheit von Säuren weiter zu Acetalen reagieren.[4]
Synthese
[Bearbeiten | Quelltext bearbeiten]Acetale bilden sich bei Umsetzung von Aldehyden oder Ketonen mit Alkoholen. Die Reaktion erfolgt in der Regel säurekatalysiert unter Abspaltung von Wasser. Als Zwischenstufe entstehen Halbacetale, wie die folgende beispielhafte Reaktion von Acetaldehyd und Methanol zeigt:[4]
Bei Verwendung von zweiwertigen Alkoholen (Diolen) läuft der zweite Schritt dieser Reaktion intramolekular ab und es entstehen cyclische Acetale. Die Zugabe einer verdünnten Säure führt zur Hydrolyse der Acetale, so dass das Gleichgewicht der obigen Reaktion nach links verschoben wird.
Acetale als Schutzgruppen
[Bearbeiten | Quelltext bearbeiten]
In der Synthesechemie werden insbesondere cyclische Acetale oft als Schutzgruppen für Carbonylgruppen benutzt. Dabei wird die hohe Beständigkeit der Acetale gegenüber Basen, Reduktions- und Oxidationsmitteln ausgenutzt, um die Carbonylgruppe beispielsweise vor Oxidation zu schützen. Nach Durchführung der gewünschten Reaktion im alkalischen Milieu kann durch Ansäuerung die Abspaltung des Diols und damit die Rückbildung der Carbonylverbindung erreicht werden.[5] Umgekehrt können auch Diole als Acetale geschützt werden. Hier wird häufig Aceton als Carbonylkomponente verwendet, da so kein stereogenes Zentrum am Acetalkohlenstoff erzeugt wird. Die Produkte dieser Reaktion werden Acetonide genannt.[6]
Beispiele
[Bearbeiten | Quelltext bearbeiten]- Benzyliden-Acetal: Wird in der Zucker-Chemie als Schutzgruppe verwendet.[7]
- Dimethoxymethan: Entzündliche Flüssigkeit mit niedrigem Siedepunkt (42 °C).[8] Gutes Lösungsmittel. Anwendung bei der Herstellung von Parfum, Harzen und Klebstoffen. Erhöht die Klopffestigkeit von Benzin.
- 1,3-Dioxolan = 1,3-Dioxacyclopentan: Verwendung als Lösungsmittel und bei der Herstellung von Polyacetalen.[9]
- Metaldehyd = 2,4,6,8-Tetramethyl-1,3,5,7-tetroxocan: Pestizid gegen Schnecken.[10]
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]O,N-Acetale
[Bearbeiten | Quelltext bearbeiten]Wenn die Carbonylgruppe eines Aldehyds oder eines Ketons mit einem 1,2-Aminoalkohol unter Wasserabspaltung umgesetzt wird, entsteht ein N,O-Acetal.
Thioacetale
[Bearbeiten | Quelltext bearbeiten]Acetale können auch mit Thiolen gebildet werden, diese nennt man Thioacetale (genauer: Dithioacetale, da beide Sauerstoffatome des Acetals durch Schwefelatome ersetzt werden). Sie unterscheiden sich in der Reaktivität von den Acetalen, was synthetischen Nutzen haben kann (Corey-Seebach-Reaktion). Setzt man einen Aldehyd oder ein Keton unter Säurekatalyse jedoch mit einem Alkohol des Typs HO–CH2–CH2–SH um, so erhält man unter Wasserabspaltung ein Monothioacetal.
S,N-Acetale
[Bearbeiten | Quelltext bearbeiten]Wenn die Carbonylgruppe eines Aldehyds oder eines Ketons mit einem 1,2-Aminothiol unter Wasserabspaltung umgesetzt wird, entsteht ein N,S-Acetal. Thiazolidine und 3-Thiazoline sind Beispiele für heterocyclische N,S-Acetale.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Verbindungen, in denen drei Alkoxygruppen oder Aryloxygruppen –OR an dasselbe Kohlenstoff-Atom gebunden sind, werden Orthoester genannt und zählen nicht zu den Acetalen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Olaf Kühl: Organische Chemie. Wiley-VCH, Weinheim 2012, ISBN 978-3-527-33199-4, S. 221.
- ↑ Eintrag zu acetals. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00062.
- ↑ Eintrag zu ketals. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.K03376.
- ↑ a b Bernd Schmidt: Grundlagen der Organischen Chemie. 5., überarbeitete und aktualisierte Auflage. De Gruyter, Berlin 2015, ISBN 978-3-11-033105-9, S. 479–481.
- ↑ Paula Y. Bruice: Organische Chemie: Studieren kompakt. 5., aktualisierte Auflage. Pearson Studium, München 2011, ISBN 978-3-86894-102-9, S. 746–747.
- ↑ Eintrag zu acetonides. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00064.
- ↑ David Crich: Mechanism of a chemical glycosylation reaction. In: Accounts of Chemical Research. Band 43, Nr. 8, 17. August 2010, S. 1144–1153, doi:10.1021/ar100035r, PMID 20496888.
- ↑ International Chemical Safety Card (ICSC) für DIMETHOXYMETHAN bei der International Labour Organization (ILO), abgerufen am 18. Juni 2023.
- ↑ 1,3-Dioxolane. In: PubChem. National Library of Medicine, 6. Mai 2022, abgerufen am 8. Mai 2022 (englisch).
- ↑ John H. Armstrong: Frequently Asked Questions about Metaldehyde For Controlling Snails and Slugs. Florida Department of Agriculture & Consumer Services, 8. Januar 2016, abgerufen am 8. Mai 2022 (englisch).