Silicate


Silicate (standardsprachlich Silikate)[1][2] sind die Salze und Ester der Ortho-Kieselsäure (Si(OH)4) und deren Kondensate. Die Ester werden unter Kieselsäureester beschrieben, für die Kondensate siehe Kieselsäuren. Alle Salze sind durch SiO4−Tetraeder aufgebaute Verbindungen, deren Tetraeder jedoch auf verschiedene Weise miteinander verknüpft sein können. Unverknüpfte Stellen der Tetraeder tragen zum Ladungsausgleich Metallkationen bei oder liegen eventuell als Hydroxidionen (OH−) vor. Mit Ausnahme der Alkalisilicate sind Silicate unlöslich in Wasser oder anderen Lösungsmitteln.
Natürliche Silicate (Silicatminerale) spielen eine große Rolle in der Mineralogie, da sich sehr viele Minerale dieser Stoffgruppe zuordnen lassen. Die Erdkruste besteht mit einem Massenanteil von über 90 % aus Silicaten und der Erdmantel fast vollständig. Die häufigsten Silicate in der Erdkruste sind mit einem Volumenanteil von 50–60 % die Feldspäte. Andere wichtige gesteinsbildende Minerale sind Glimmer, Tonminerale, Amphibole, Pyroxene, Granat und Olivin. Das häufige Mineral Quarz (SiO2) wird in deutschsprachiger Literatur zu den Oxiden gezählt, im anglo-amerikanischen Schrifttum jedoch zu den Silicaten.
Struktur
[Bearbeiten | Quelltext bearbeiten]

Allen Silicatmineralen ist ein gemeinsames Bauprinzip eigen, deshalb lassen sie sich relativ einfach in eine systematische Ordnung bringen. Die Grundbausteine aller Silicate sind SiO4-Tetraeder. Ein Siliciumatom ist dabei von vier Sauerstoffatomen umgeben. Die Sauerstoffatome berühren sich wegen ihrer Größe, in der Mitte bleibt Platz für das relativ kleine Siliciumatom (der freie Raum heißt Tetraederlücke).
Eine weitere Eigenschaft der Silicate besteht in der Fähigkeit der Sauerstoffatome, gleichzeitig an verschiedenen SiO4-Komplexen teilzuhaben. Daraus ergeben sich neben isolierten SiO4-Tetraedern weitere, zusammengesetzte Bauelemente:
- isolierte Tetraeder
- Doppeltetraeder
- Ringstrukturen
- Einfach- und Doppelketten
- Schichtstrukturen
- Gerüststrukturen.
Aluminium kann das sich chemisch ähnlich verhaltende Silicium ersetzen und substituieren (man spricht hier von „isomorphem Ersatz“), Silicate, in denen dies passiert, nennt man Alumosilicate. Bei Einbau von Aluminium (Al3+ statt Si4+) in das Mineralgitter muss Ladungsausgleich durch Einbau weiterer positiv geladener Ionen (Kationen) erfolgen.
Systematik der Silicatminerale
[Bearbeiten | Quelltext bearbeiten]Die Silicate bilden wie bereits erwähnt eine äußerst ausgedehnte Mineralfamilie. Es treten große Unterschiede hinsichtlich chemischer Zusammensetzung, Kristallsymmetrie, Bindungsarten und Struktur der Grundbausteine auf, weshalb verschiedene Klassifikationsschemata für Silicatminerale bestehen. Die in Deutschland übliche Systematik teilt sie nach dem Grad der Polymerisation der SiO4-Tetraeder ein.
Bemerkungen zur Schreibweise der chemischen Summenformeln
[Bearbeiten | Quelltext bearbeiten]Eine vereinfachte schematische Formel von Silicaten ist:
- .
An die Stelle der Sauerstoff-Siliciumkomplexe können Hydroxid- oder Fluoridionen treten. Die Position von „M“ wird von einem oder mehreren Metallionen bis zum Ladungsausgleich besetzt. In das Gitter von besonders weitmaschigen Silicaten kann auch Wasser eingelagert werden. Wenn in einem bestimmten Mineral tatsächlich einige der SixOy-Komplexe durch Ionen wie Fluorid (F−) oder Hydroxid (OH−) ersetzt werden, so deutet man das durch senkrechte Trennstriche (oft auch Schrägstriche) im letzten Term der Formel an, zum Beispiel
- , Kaolinit.
Eingelagertes Wasser wird folgendermaßen notiert:
- , Analcim.
Klassifizierung nach dem Polymerisationsgrad der SiO4-Tetraeder
[Bearbeiten | Quelltext bearbeiten]Inselsilicate (Nesosilicate)
[Bearbeiten | Quelltext bearbeiten]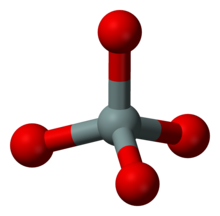
Bei den Inselsilicaten liegen isolierte SiO4-Tetraeder vor. Vertreter:
Gruppensilicate (Sorosilicate)
[Bearbeiten | Quelltext bearbeiten]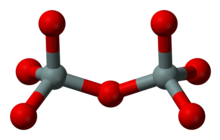
Je zwei SiO4-Komplexe sind über ein Sauerstoffatom zu Doppeltetraedern verbunden, wobei dieser so genannte Brückensauerstoff jedem SiO4-Tetraeder zur Hälfte angehört. Das Si:O-Verhältnis in Gruppensilikaten ist damit 2:7. Diese Struktur kommt weniger häufig vor, ein Beispiel ist das Mineral Gehlenit (Ca2Al[(Si,Al)2O7]).
Ringsilicate (Cyclosilicate)
[Bearbeiten | Quelltext bearbeiten]In Ringsilicaten sind die SiO4-Tetraeder zu isolierten Dreier-, Vierer- und Sechserringen gruppiert. Jedes Siliciumion teilt sich je zwei Sauerstoffionen mit zwei benachbarten Tetraedern, dies ergibt ein Si:O-Verhältnis in Ringsilicaten von 1:3. Es ergeben sich die folgenden Formeln für die Ringstrukturen:
- [Si3O9]6−
- [Si4O12]8−
- [Si6O18]12−.
Beryll (Al2Be3[Si6O18]) und die Minerale der Turmalingruppe gehören zu den Ringsilicaten.
Ketten- und Bandsilicate (Inosilicate)
[Bearbeiten | Quelltext bearbeiten]

Zu den Kettensilicaten gehören zwei wichtige Gruppen von gesteinsbildenden Mineralen: Pyroxene und Amphibole. Die Pyroxene bilden eindimensionale Einfachketten, dabei gehören je zwei der Sauerstoffionen gleichzeitig zwei Tetraederkomplexen an, woraus sich ein Si:O-Verhältnis von 1:3 ergibt, wie bei Diopsid (CaMg[Si2O6]).
Amphibole bilden eindimensionale Bänder. Dabei sind zwei Ketten seitlich über Brückensauerstoffe verbunden. Gegenüber den Ketten hat zusätzlich jeder zweite Tetraeder jeder Kette mit seinem jeweiligen Nachbarn ein Sauerstoffion gemeinsam. Das Si:O-Verhältnis bei Bandsilicaten beträgt 4:11. In solchen silicatischen Bändern sind Hohlräume vorhanden, in die (OH)−- und F−-Ionen eintreten können. In der chemischen Summenformel wird das durch einen vertikalen Strich zum Ausdruck gebracht. Ein Mineral aus der Gruppe der Amphibole ist Aktinolith (Ca2(Mg,Fe)5[(OH)2|Si8O22]).
Schichtsilicate (Phyllosilicate)
[Bearbeiten | Quelltext bearbeiten]
Bei höherem Polymerisationsgrad bilden sich statt Kettenstrukturen Schichtstrukturen aus SiO4-Tetraedern. Innerhalb einer Schicht teilt sich dabei jedes Siliciumatom drei seiner Sauerstoffionen mit seinen Nachbarn. Das Si:O-Verhältnis der Schichtsilicate beträgt 2:5. Die Schichtsilicate werden unterteilt in Zwei- und Dreischichtsilicate. Eine weitere Unterteilung berücksichtigt die Struktur und die Ionen, die sich zwischen zwei Tetraederschichten befinden. Der Hohlraum zwischen zwei Schichten kann mit (-OH), (-O−Me+) besetzt sein und die Schichten mit Dipol-Dipol-Kräften oder Ionenbindungen verknüpfen.
Zu den Schichtsilicaten gehören Mineralgruppen wie Glimmer, Talk, Serpentin und Tonminerale wie Vermiculit, Beispiele sind Muskovit (ein Dreischichtsilicat) (KAl2[(OH)2|AlSi3O10]) und Kaolinit (ein Zweischichtsilicat) (Al4[(OH)8|Si4O10]).
Synthetische Schichtsilicate, wie SKS-6 (Na2Si2O5) werden in Waschmitteln verwendet.[3] SKS-6 Schichtsilicate zeigen Eigenschaften wie Natrium-Zeolithe. Die schichtverknüpfenden, hydratisierten Natriumionen sind in Suspensionen selektiv austauschbar, beispielsweise gegen Calciumionen, und eignen sich somit zur Wasserenthärtung als Ionentauscher und zeigen gute Eigenschaften als Waschalkalie.
Gerüstsilicate (Tectosilicate)
[Bearbeiten | Quelltext bearbeiten]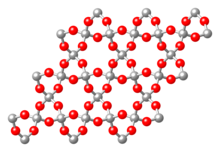
Bei Gerüstsilicaten gehört jedes Sauerstoffion gleichzeitig zwei benachbarten Tetraedern an (jeder Tetraeder ist über seine Ecken mit Nachbartetraedern verknüpft). Dadurch entstehen dreidimensionale Netzwerkstrukturen. Es ergibt sich die chemische Summenformel SiO2. Stellvertretend für Siliciumdioxid-Verbindungen sei der hier dargestellte Quarz in der Modifikation β-Quarz genannt. Für weitere Gerüstsilicate muss Silicium durch Aluminium ersetzt werden. Der Ladungsausgleich erfolgt durch Einlagerung von Kationen. Zu den Gerüstsilicaten gehören die Feldspäte und Feldspatvertreter, eine wegen ihrer Häufigkeit außerordentlich wichtige Gruppe von Mineralen. Beispiele sind Minerale aus der Mischreihe der Plagioklase (Albit – Anorthit): (NaAlSi3O8 – CaAl2Si2O8).
In das weitmaschige Gitternetz einiger Feldspatvertreter können sogar große Moleküle wie H2O eingebaut werden. Bei hoher Temperatur entweicht das Wasser, wird jedoch bei niedriger Temperatur in mit Wasserdampf gesättigter Umgebung wieder ins Kristallgitter eingebaut. Diese wasserhaltigen Minerale gehören zur Gruppe der Zeolithe (z. B. Natrolith (Na2[Al2Si3O10]·nH2O)).
Amorphe Silicate
[Bearbeiten | Quelltext bearbeiten]
Opal ist amorphes Siliciumdioxid mit eingelagertem Wasser (SiO2 · n H2O). Er wird wie Quarz von einigen Autoren zu den Oxidmineralen gestellt. Die hochstrukturierten Schalen von Kieselalgen (Diatomee) und von Strahlentierchen (Radiolaria) sind aus amorphem Siliciumdioxid (SiO2) aufgebaut.
Klassifikation nach Kostov
[Bearbeiten | Quelltext bearbeiten]Diese Einteilung beruht hauptsächlich auf der chemischen Zusammensetzung des Silicats und seiner Kristallmorphologie.
Technische Silicate
[Bearbeiten | Quelltext bearbeiten]- Viele Silicate werden industriell gefertigt. Hier sind an prominentester Stelle die Gläser und Glaskeramiken zu nennen, aber auch Zirkonsilikate als Farbpigmente. Diese werden in der Regel aus Quarzsand (SiO2) und Metalloxiden in einem Glasschmelzofen hergestellt.
- In Wasser lösliche Gläser, sogenannte Wassergläser, werden aus Quarzsand und Metallcarbonaten (mit Soda Na2CO3) in einem Glasschmelzofen hergestellt. Sie werden als Klebstoff, Füllstoff in der Papierindustrie, zum Abdichten von feuchtem Mauerwerk, Zusatz in diffusionsoffenen Putzmischungen verwendet. Aus Wasserglas werden großtechnisch durch Reaktion mit Säuren Gele (Silicagel), Kieselsäure, Silicate und Zeolithe hergestellt.
- Talk ist vielseitig verwendbar. Er wird in der Farben- und Glasindustrie und als Schmiermittel verwendet. Als gemahlener Grundstoff (dann Talcum genannt) ist er in vielen Kosmetika enthalten.
- Asbest (Chrysotil) wurde auf Grund seiner Feuerfestigkeit und seiner Eignung als Isolier- und Dämmmaterial besonders im Baugewerbe verwendet, ist aber wegen gesundheitsschädigender Nebenwirkungen in der EU seit 2005 verboten. Zur Herstellung feuerfester und korrosionsbeständiger Werkstoffe sind auch die Minerale Zirkon, Muscovit, Andalusit, Sillimanit und Disthen geeignet.
- Kaolinit ist ein wichtiger Rohstoff für die Keramikindustrie zur Herstellung feuerfester Tiegel und von Mauer- und Dachziegeln.

- Zeolithe, insbesondere das synthetische Zeolith A, werden als Ionentauscher (so genannte Molekularsiebe) verwendet und dienen als Phosphat-Ersatz zur Enthärtung von Wasser, besonders in Waschmitteln. Um eine Eutrophierung von Zierteichen zu verhindern, werden Nährstoffe (Ammoniumverbindungen) mit Zeolithen entzogen und besonders das Algenwachstum gehemmt. Neben diesen Alumosilicaten wurden synthetische Schichtsilicate (s. o.) mit ähnlichen Eigenschaften gefunden.
- Nanosilicate eignen sich wegen ihrer großen Oberfläche und Adsorptionsfähigkeit als Träger für Katalysatormaterialien oder medizinische Wirkstoffe. Sie können beispielsweise per Stöber-Synthese[4] oder großtechnisch als pyrogenes Siliciumdioxid (Aerosil) hergestellt werden.
- In der Trinkwasseraufbereitung werden Silicate als Korrosionsinhibitor weit verbreitet eingesetzt. Als wirksame Inhibitoren sind Phosphat-Silicat-Gemische und phosphatfreie, carbonataktivierte Silicate bekannt.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]- Silicate kommen in allen Wässern in niedriger Konzentration gelöst vor.
- Manche Organismengruppen bilden kieselige Skelette, die Hauptproduktion erfolgt vermutlich durch planktonisch lebende Organismen wie Kieselalgen (Diatomeen) und Strahlentierchen (Radiolarien). Manche Schwämme bauen ebenfalls kieselige Gerüststrukturen auf.
- Alle erdähnlichen Planeten bestehen zu einem großen Teil aus Silicaten.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Als Schmuck- und Edelsteine
[Bearbeiten | Quelltext bearbeiten]- Die Inselsilicate Granat, Olivin, Topas und Zirkon werden in reiner Qualität als Schmucksteine verkauft.
- Die Quarzvarietäten Amethyst, Aventurin-Quarz, Chalcedon, Citrin, Moosachat sind beliebte Schmucksteine.
- Die Feldspäte Amazonit, Aventurin-Feldspat, Labradorit und der Feldspatvertreter Sodalith werden als Schmucksteine verwendet.
- Die Edelsteine Smaragd und Aquamarin sind eine Varietät von Beryll.
Industrie
[Bearbeiten | Quelltext bearbeiten]- in Silikatglas (Bauglas)
- in Borosilikatglas (Laborglas), auch als Material für Küchengeschirr aus Glas (Duran, Jenaer Glas, Pyrex) oder als Displayabdeckung für technische Geräte (Willow Glass)
- in Aluminosilikatglas (siehe Alumosilicate) als Glas mit hoher Feuerbeständigkeit (nach DIN EN 1059)[5] und als kratzbeständige Displayabdeckung für technische Geräte (Gorilla Glass)
- in Bleiglas
- in undotierten und dotierten Siliciumdoxidschichten, hier oft als Silicatglas bezeichnet, z. B. Borphosphorsilicatglas, einem mit je 3 bis 5 % Bor und Phosphor dotiertem Silicatglas, das in der Halbleitertechnik unter anderem zur Planarisierung der Oberfläche eingesetzt wird
- in der Waschmittelindustrie
- als hochabsorbe, geruchsneutralisierende Katzenstreu
- als Brandschutzbauplatten
- in Farben
Nachweis
[Bearbeiten | Quelltext bearbeiten]Silicat kann mit der Wassertropfenprobe nachgewiesen werden. Die Substanz wird in einem Bleitiegel mit Calciumfluorid und Schwefelsäure versetzt. In Anwesenheit von Siliciumdioxid entsteht gasförmiges Siliciumtetrafluorid, das an einem befeuchteten, schwarzen Filterpapier über der Tiegelöffnung wieder zu weißem Siliciumdioxid kondensiert
- Fluoridanionen reagieren mit Schwefelsäure zu Sulfatanionen und Fluorwasserstoff.
- Siliciumdioxid reagiert mit Fluorwasserstoff zu Siliciumtetrafluorid und Wasser. Die Hinreaktion läuft unten im Tiegel ab, die Rückreaktion oben am Deckel.
Literatur
[Bearbeiten | Quelltext bearbeiten]- W. L. Bragg: The structure of silicates. In: Z. Kristallogr. 74. 1930, 237–305.
- W. A. Deer, W. A. Howie und J. Zussman: Rock-Forming Minerals, Volume 1A: Orthosilicates. Longman, London, 2. Auflage, 1982.
- I. Kostov: Crystal chemistry and classification of silikate minerals. In: Geokhimiya, Mineralogiya i Petrologiya. 1. 1975, 5–41.
- F. Liebau: Die Systematik der Silicate. In: Naturwissenschaften. 49. 1962, 481–491.
- F. Liebau: Structural Chemistry of Silicates. Springer-Verlag, Berlin 1985.
- Martin Okrusch, Hartwig E. Frimmel: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. Springer-Verlag, Berlin, 10. Auflage, 2022.
- S. Na’ray-Szabo: Ein auf der Kristallstruktur basierendes Silicatsystem. In: Z. Physik. Chem. Abt. B9. 1930, 356–377.
- H. Pichler und C. Schmitt-Riegraf: Gesteinsbildende Minerale im Dünnschliff. Enke Verlag 1987.
- P. H. Ribbe: Reviews in mineralogy Volume 5: Orthosilicates. Mineralogical Society of America, Washington, 2. Auflage, 1982
- J. V. Smith und W. L. Brown: Feldspar Minerals, Volume 1. Springer-Verlag, Berlin, 2. Auflage; 1988
- H. Strunz: Strunz mineralogical tables : chemical structural mineral classification system. 9. Auflage, Schweizerbart, Stuttgart. ISBN 978-3-510-65188-7
- W. E. Tröger: Optische Bestimmung der gesteinsbildenden Minerale, Teil 1: Bestimmungstabellen. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 4. Auflage, 2001.
- W. E. Tröger: Optische Bestimmung der gesteinsbildenden Minerale, Teil 2: Textband. Schweizerbart’sche Verlagsbuchhandlung, Stuttgart, 1967.
- T. Zoltai: Classifikation of silicates and other minerals with tetrahedral structures. In: American mineralogist. 45. 960–973, 1960
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Mineralienatlas:Silikat (Wiki)
- Komplette Vorlesung über Silikate von ruby.chemie.uni-freiburg.de
- Mineralogie-web.de
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Duden Silikat. Abgerufen am 6. Oktober 2021.
- ↑ DWDS Silikat. Abgerufen am 6. Oktober 2021.
- ↑ WeylClean® SKS-6 - The WeylChem Group. Abgerufen am 9. August 2019 (englisch).
- ↑ Werner Stöber, Arthur Fink, Ernst Bohn: Controlled growth of monodisperse silica spheres in the micron size range. In: Journal of Colloid and Interface Science. 26, 1968, S. 62–69, doi:10.1016/0021-9797(68)90272-5.
- ↑ Christian Schittich, Gerald Staib, Dieter Balkow, Matthias Schuler, Werner Sobek: Glasbau Atlas. Walter de Gruyter, 2006, ISBN 3-0346-1553-1, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
![{\displaystyle \mathrm {M_{n}\left[\left(Si_{x}O_{y}\right)^{4x-2y}\right]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c87a4e9317d60e092bbfa12fe016989317f4eab)
![{\displaystyle \mathrm {Al_{2}\left[Si_{2}O_{5}|(OH)_{4}\right]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/becfd5c3837eab509f18e757afad1e1b76a9412d)
![{\displaystyle \mathrm {Na[AlSi_{2}O_{6}]\cdot H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/49ce7b36050eb923fba911f9a5f09324b83f0ec3)
![{\displaystyle \mathrm {(Mg,Fe)_{2}[SiO_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f6d176c33cf50d1c311fa6fbe06e2dc17d7143d)
![{\displaystyle \mathrm {Zr[SiO_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e76a30cfbd1a061aa1ea321cda5fcb39bd09e348)

