Skelettformel
Die Skelettformel (auch Gerüstformel, englisch skeletal formula) einer organischen Verbindung ist eine Strukturformel, die eine knappe Darstellung der Molekülstruktur erlaubt. Skelettformeln sind allgegenwärtig in der organischen Chemie, da sie nicht nur komplizierte Strukturen klar aufzeigen können, sondern auch schnell und einfach zu zeichnen sind.
| Strukturformeln | andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronen- formel |
Valenzstrich- formel |
Keilstrich- formel |
Skelett- formel |
Konstitutions- formel |
Summen- formel |
Verhältnis- formel | |
| Methan | 
|

|

|
existiert nicht |
CH4 | CH4 | CH4 |
| Propan | 
|

|

|
CH3–CH2–CH3 oder CH3 CH2 CH3 |
C3H8 | C3H8 | |
| Essigsäure | 
|

|
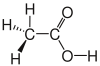
|

|
CH3–COOH oder CH3 COOH |
C2H4O2 | CH2O |
| Wasser | existiert nicht |
H–O–H oder H O H |
H2O | H2O | |||
Das Kohlenstoffskelett
[Bearbeiten | Quelltext bearbeiten]Der Begriff Skelett bezieht sich auf das Kohlenstoffskelett einer organischen Verbindung, welches durch die Hauptketten, Seitenketten und/oder Ringe die Basis einer organischen Verbindung bildet. Wasserstoffatome sind die häufigsten Atome, die an Kohlenstoffatome gebunden sind, und werden genau wie die Kohlenstoffatome nicht explizit eingezeichnet. Alle anderen Atome werden als Heteroatome bezeichnet; sie bilden funktionelle Gruppen. Diese werden auch als Substituenten bezeichnet, da sie im Molekül ein bestimmtes, an Kohlenstoff gebundenes Wasserstoffatom substituieren (lat.: ersetzen).
Implizierte Kohlenstoff- und Wasserstoffatome
[Bearbeiten | Quelltext bearbeiten]
In Valenzstrichformeln werden Kohlenstoffatome durch das Elementsymbol „C“ dargestellt, Wasserstoffatome durch „H“. In Skelettformeln wird das Vorhandensein und die Lage dieser Atome zwar nicht dargestellt, aber automatisch vorausgesetzt, d. h. impliziert. Die Darstellung des Kohlenstoffgerüstes erfolgt über das Zeichnen der Bindungen zwischen den Kohlenstoffatomen. Für jedes Kohlenstoffatom wird eine Ecke gezeichnet.
Da Kohlenstoffatome normalerweise 4 Atombindungen ausbilden, wird die Anzahl der angelagerten Wasserstoffatome berechnet, indem die Anzahl der Bindungen des Kohlenstoffatoms von 4 subtrahiert wird. Beispielsweise ist rechts die Skelettformel von Hexan dargestellt. Das mit „C1“ bezeichnete Kohlenstoffatom besitzt nur eine Bindung, also müssen drei Wasserstoffatome an dieses Kohlenstoffatom gebunden sein. Im Vergleich dazu muss „C3“ zwei Wasserstoffatome angelagert haben, denn es hat zwei Bindungen ausgebildet.

Die Wasserstoffatome von funktionellen Gruppen werden dagegen explizit dargestellt. Ein Beispiel dafür ist die Hydroxygruppe des Ethanols. Die funktionellen Gruppen werden aus Gründen der Klarheit und Kompaktheit als Einheit und ohne Bindungslinien geschrieben. In manchen Fällen, z. B. um ihre Rolle in gewissen Reaktionsmechanismen hervorzuheben, werden diese jedoch eingezeichnet.

Weiterhin werden einzelne Wasserstoffatome auch dann dargestellt, wenn deren Position für eine stereochemische Charakterisierung relevant ist, wie beispielsweise beim Nicotin.
Explizite Heteroatome
[Bearbeiten | Quelltext bearbeiten]Alle Atome, die nicht Kohlenstoff oder Wasserstoff sind, also alle Heteroatome, werden mit ihrem Elementsymbol dargestellt, so z. B. „Cl“ für Chlor, „O“ für Sauerstoff oder „Na“ für Natrium.
Pseudoelemente
[Bearbeiten | Quelltext bearbeiten]Einige Zeichen sehen wie chemische Elemente aus, stellen jedoch häufig vorkommende funktionellen Gruppen oder ein beliebiges Atom aus einer Gruppe dar. Häufig wird z. B. „Ph“ für die Phenylgruppe verwendet.
Es existieren außerdem:
Isotope
[Bearbeiten | Quelltext bearbeiten]Elemente
[Bearbeiten | Quelltext bearbeiten]- X für ein beliebiges Halogenatom
- M für ein beliebiges Metallatom
Alkylgruppen
[Bearbeiten | Quelltext bearbeiten]- R für jede Alkylgruppe oder jeden möglichen Substituenten überhaupt
- Me für die Methylgruppe
- Et für die Ethylgruppe
- n-Pr für die Propylgruppe
- i-Pr für die Isopropylgruppe (iso-Propylgruppe)
- Bu für die Butylgruppe, wobei meist die n-Butylgruppe gemeint ist
- i-Bu für die Isobutylgruppe (iso-Butylgruppe)
- s-Bu für die sek-Butylgruppe
- t-Bu für die tert-Butylgruppe
- Pn für die Pentylgruppe, wobei meist die n-Pentylgruppe gemeint ist
- Hx für die Hexylgruppe, wobei meist die n-Hexylgruppe gemeint ist
- Hp für die Heptylgruppe, wobei meist die n-Heptylgruppe gemeint ist
- Cy für die Cyclohexylgruppe
Aromatische Substituenten
[Bearbeiten | Quelltext bearbeiten]- Ar für jeden aromatischen Substituenten – von Aryl-Rest – (Ar ist auch das Symbol für das Element Argon. Da bisher nur eine Argon-Verbindung bekannt ist, besteht hier jedoch keine Verwechselungsgefahr)
- Bn für die Benzylgruppe
- Bz für die Benzoylgruppe
- Ph für die Phenylgruppe
- Tol für die Tolylgruppe, wobei meist die p-Tolylgruppe (4-Methylphenylgruppe) gemeint ist
- Xy für die Xylylgruppe
Funktionelle Gruppen
[Bearbeiten | Quelltext bearbeiten]- Ac für die Acetylgruppe (Ac ist auch das Symbol für das Element Actinium. Actiniumverbindungen sind jedoch so selten, dass diese Konvention kaum zu Verwechselungen führen kann)
Abgangsgruppen
[Bearbeiten | Quelltext bearbeiten]Siehe den Artikel Abgangsgruppe für weitere Informationen
- Bs für die Brosylgruppe
- Ns für die Nosylgruppe
- Tf für die Triflylgruppe
- Ts für die Tosylgruppe
Mehrfachbindungen
[Bearbeiten | Quelltext bearbeiten]Zwei Atome können durch mehr als nur ein Elektronenpaar gebunden sein. Aufgrund der geometrischen und physikalischen Möglichkeiten ergeben sich Einfach-, Doppel- und Dreifachbindungen. Einfachbindungen werden durch einfache Linien zwischen zwei Atomen dargestellt, Doppelbindungen durch zwei parallele Linien und Dreifachbindungen durch drei parallele Linien.
In komplexeren Bindungstheorien existieren nicht-ganzzahlige Bindungswerte. In diesem Fall wird eine Kombination aus durchgezogenen und gestrichelte Linien gezeichnet, die jeweils die ganzzahligen und nicht-ganzzahligen Teile der Bindung darstellen sollen.
-
Hex-3-en hat eine innere Kohlenstoff-Kohlenstoff-Doppelbindung
-
Hex-1-en hat eine terminale (abschließende) Doppelbindung
-
Hex-3-in hat eine innere Kohlenstoff-Kohlenstoff-Dreifachbindung
-
Hex-1-in hat eine terminale (abschließende) Dreifachbindung
N.B. in der oberen Darstellung wurden Doppelbindungen in rot und Dreifachbindungen in blau gezeichnet. Die farbliche Markierung erfolgte nur aus Gründen der Verständlichkeit. Mehrfachbindungen sind normalerweise nicht farblich dargestellt.

Es liegt in der Natur der Darstellung, dass langkettige Alkane in der Skelettformel nicht linear gezeichnet werden können (Die Kohlenstoffatome werden durch die Knicke zwischen den Bindungen gekennzeichnet). Aus den Winkeln in der Kohlenstoffkette lässt sich die planare Darstellung von Tetraederwinkeln ableiten. Dadurch stellt eine Skelettformel die cis-trans-Isomerie, die bei Doppelbindungen auftritt, immer korrekt dar.
Im Beispiel oben sind also die trans- bzw. (E)-Konfigurationen der Doppelbindungen dargestellt. Die Dreifachbindungen sind nicht tetraedisch dargestellt, da an Kohlenstoff-Kohlenstoff-Dreifachbindungen kein weiteres Wasserstoffatom angelagert sein und somit auch keine cis-trans-Isomerie vorliegen kann. Rechts dargestellt sind zwei cis- bzw. (Z)-C=C-Doppelbindungen, bei der die Carboxygruppe COOH teilweise gezeichnet wurde.
Benzolringe
[Bearbeiten | Quelltext bearbeiten]
Benzolringe treten häufig in organischen Verbindungen auf. Um die Delokalisierung der Elektronenpaare über die sechs Kohlenstoffatome im Ring darzustellen, wird ein Kreis innerhalb eines Hexagons aus Einfachbindungen gezeichnet. Dieser Stil ist vor allem in Schulbüchern sehr verbreitet.
Eine Alternative dazu, die in der Wissenschaft oft genutzt wird, ist die Kekuléstruktur. Diese Darstellungsweise gilt als ungenau, da sie drei Einfach- und drei Doppelbindungen unterstellt (Benzol wäre demnach Cyclohexa-1,3,5-trien). Die Vorteile der Darstellungsweise bestehen jedoch darin, dass mit ihr Reaktionsmechanismen eindeutig dargestellt werden können. Die Verwendung der Kekulé-Darstellung setzt jedoch das Wissen um die Elektronenpaardelokalisierung voraus.
Stereochemie
[Bearbeiten | Quelltext bearbeiten]Stereochemische Eigenschaften werden in geeigneter Weise in Skelettformeln dargestellt:
- Durchgezogene Linien stehen für Atombindungen in der Ebene der Darstellung
- Keilförmige Linien stehen für Bindungen, die in einer höheren Schicht liegen, also in einer Ebene, die sich näher beim Betrachter befindet
- Gestrichelte Linien stehen für Bindungen, die in einer tieferen Schicht liegen, also in einer Ebene, die sich weiter vom Betrachter weg befindet
- Geschwungene, wellenförmige Linien stehen entweder für unbekannte Stereochemie oder für eine racemische Mischung aus beiden möglichen Enantiomeren.
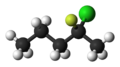
-
2-Chlor-2-fluorpentan.
-
Die stereochemische Skelettformel von (R)-2-Chlor-2-fluorpentan.
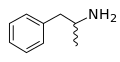
-
Die Skelettformel von Amphetamin, die dessen racemische Natur zum Ausdruck bringen soll.
Andere Darstellungsarten von Bindungen
[Bearbeiten | Quelltext bearbeiten]Wasserstoffbrückenbindungen werden manchmal durch gepunktete oder gestrichelte Linien angedeutet. In einigen Fällen werden die unter Stereochemie angesprochenen keilförmigen Linien auch genutzt, um die Oxidationszahl bestimmen zu können. In diesem Fall zeigt der Keil auf das elektronegativere Atom einer Bindung. Die Zählung ergibt sich dann relativ simpel, indem bei jedem Atom −I für jeden Keil und +I für jede Spitze gezählt wird.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Organische Moleküle zeichnen, chemguide.co.uk (englisch)